Myxobolus cerebralis -Myxobolus cerebralis
| Myxobolus cerebralis | |
|---|---|
|
|
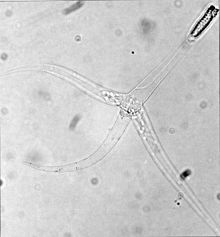
| Stadium triactinomyxon Myxobolus cerebralis - zwróć uwagę na trzy „ogony” | |
|
Klasyfikacja naukowa |
|
| Królestwo: | Animalia |
| Gromada: | Cnidaria |
| Klasa: | Myxosporea |
| Zamówienie: | Bivalvulida |
| Rodzina: | Myxobolidae |
| Rodzaj: | Myksobolus |
| Gatunek: |
M. cerebralis
|
| Nazwa dwumianowa | |
|
Myxobolus cerebralis
Hofera , 1903
|
|
| Synonimy | |
|
Myxosoma cerebralis |
|
Myxobolus cerebralis jest myxosporean pasożyta z ryb łososiowatych ( łososia , pstrąga , a sojuszników), który powoduje wirujących choroby w hodowlanej łosoś i pstrąg, a także w dzikich populacji ryb . Po raz pierwszy został opisany u pstrąga tęczowego w Niemczech sto lat temu, ale jego zasięg rozprzestrzenił się i pojawił się w większości krajów Europy (w tym w Rosji), Stanach Zjednoczonych, RPA, Kanadzie i innych krajach. W latach 80. stwierdzono, że M. cerebralis wymaga skąposzczetu rurkowatego (rodzaj robaka segmentowego ), aby zakończyć swój cykl życiowy. Pasożyt infekuje swoich gospodarzy swoimi komórkami po przebiciu ich polarnymi włóknami wyrzuconymi zkapsułek przypominających nicienie.
Choroba wirowa dotyka młodociane ryby (paluszki i narybek) i powoduje deformację szkieletu oraz uszkodzenia neurologiczne . Ryby „wirują” do przodu w niezgrabnym, korkociągowym wzorze zamiast normalnie pływać, mają trudności z żerowaniem i są bardziej podatne na ataki drapieżników . Śmiertelność palcowatych jest wysoka, do 90% zakażonych populacji, a te, które przeżyją, są zdeformowane przez pasożyty rezydujące w ich chrząstce i kości . Pełnią rolę rezerwuaru dla pasożyta, który po śmierci ryby jest uwalniany do wody. M. cerebralis jest jednym z najważniejszych gospodarczo myksozoanów ryb, a także jednym z najbardziej patogennych. Był to pierwszy myksosporean, którego patologię i objawy zostały naukowo opisane. Pasożyt nie przenosi się na ludzi.
Taksonomia
Systematyka i nazewnictwo obu M. cerebralis , i myxozoans w ogóle, mają skomplikowane historie. Początkowo sądzono, że infekuje mózgi ryb (stąd specyficzny epitet cerebralis ) i układ nerwowy , chociaż wkrótce odkryto, że infekuje przede wszystkim chrząstki i tkankę szkieletową . Próby zmiany nazwy na Myxobolus chondrophagus , która dokładniej opisałaby organizm, nie powiodły się ze względu na zasady nazewnictwa . Później stwierdzono, że organizmy wcześniej nazywane Triactinomyxon dubium i T. gyrosalmo ( klasa Actinosporea ) są w rzeczywistości stadiami triactinomyxon M. cerebralis , których cykl życiowy został rozszerzony o stadium triactinomyxon. Podobnie inne promieniowce zostały złożone w cykle życiowe różnych myksosporów.
Dziś myksozoany, wcześniej uważane za wielokomórkowe pierwotniaki , większość naukowców uważa za zwierzęta , choć ich status oficjalnie się nie zmienił. Ostatnie badania molekularne sugerują, że są one spokrewnione z Bilateria lub Cnidaria , przy czym Cnidaria jest bliżej morfologicznie, ponieważ obie grupy mają wytłaczane włókna. Bilateria były nieco bliższe w niektórych badaniach genetycznych, ale okazało się, że wykorzystywały próbki, które zostały skażone materiałem z organizmu żywiciela, a badanie z 2015 r. potwierdza, że są to parzydełka.
Morfologia
M. cerebralis ma wiele różnych stadiów, od pojedynczych komórek do stosunkowo dużych zarodników, z których nie wszystkie zostały szczegółowo zbadane.
Etap triaktynomyksonu
Stadia, które infekują ryby, zwane zarodnikami triaktynomiksonów , składają się z jednego stylu o długości około 150 mikrometrów (μm) i trzech wyrostków lub „ogonów”, każdy o długości około 200 mikrometrów. Sporoplasm pakiet na koniec stylu zawiera 64 komórek rozrodczych otoczone kopercie komórkowym. Istnieją również trzy kapsuły polarne , z których każda zawiera zwinięte włókno polarne o długości od 170 do 180 μm. Włókna polarne zarówno na tym etapie, jak i na etapie myksosporów (patrz rysunek powyżej) szybko wystrzeliwują do ciała żywiciela, tworząc otwór, przez który może wejść sporoplazma.
Stadium zarodnikowe
Po kontakcie z żywicielami ryb i wystrzeleniu kapsułek polarnych, sporoplazma zawarta w centralnej części triaktynomiksonów migruje do nabłonka lub wyściółki jelita. Po pierwsze, sporoplazma przechodzi mitozę, aby wytworzyć więcej komórek ameboidalnych , które migrują do głębszych warstw tkanki, aby dotrzeć do chrząstki mózgowej.
Stadium myksosporejskie
Myksospory, które rozwijają się z komórek sporogonicznych wewnątrz żywicieli ryb, są soczewkowate. Mają średnicę około 10 mikrometrów i składają się z sześciu ogniw. Dwie z tych komórek tworzą kapsuły polarne, dwie łączą się tworząc dwujądrową sporoplazmę, a dwie tworzą zastawki ochronne. Myksospory są zakaźne dla skąposzczetów i znajdują się wśród szczątków strawionej chrząstki rybiej. Często trudno je odróżnić od spokrewnionych gatunków ze względu na podobieństwa morfologiczne między rodzajami . Chociaż M. cerebralis jest jedynym myksosporami, jakie kiedykolwiek znaleziono w chrząstce łososiowatej, inne wizualnie podobne gatunki mogą być obecne w skórze, układzie nerwowym lub mięśniach .
Koło życia
Myxobolus cerebralis ma cykl życiowy dwóch żywicieli, obejmujący ryby łososiowate i skąposzczety rurkowate. Jak dotąd jedynym robakiem, o którym wiadomo, że jest podatny na infekcję M. cerebralis, jest Tubifex tubifex , chociaż to, co naukowcy obecnie nazywają T. tubifex, może w rzeczywistości należeć do więcej niż jednego gatunku. Po pierwsze, myksospory są spożywane przez robaki tubificid. W świetle jelita robaka zarodniki wyciskają swoje polarne kapsułki i przyczepiają się do nabłonka jelita za pomocą włókien polarnych . Zastawki muszli następnie otwierają się wzdłuż linii szwu, a dwujądrowa komórka zarodkowa wnika między komórki nabłonka jelitowego robaka. Ta komórka namnaża się , wytwarzając wiele komórek ameboidalnych w procesie rozszczepiania komórek bezpłciowych zwanym merogonią . W wyniku procesu namnażania może dojść do zakażenia przestrzeni międzykomórkowej komórek nabłonka w więcej niż 10 sąsiednich segmentach robaka.
Około 60-90 dni po zakażeniu, stadia komórek płciowych pasożyta przechodzą sporogenezę i rozwijają się w pansporocysty , z których każda zawiera osiem zarodników w stadium triaktynomiksonów. Zarodniki te są uwalniane z odbytu skąposzczetów do wody. Alternatywnie, ryba może zostać zarażona poprzez zjedzenie zakażonego skąposzczetu. Zainfekowane rurkowate mogą uwalniać triaktynomiksony przez co najmniej rok. Zarodniki triaktynomyksonu są przenoszone przez prądy wodne, gdzie mogą zarażać łososiowate przez skórę. Penetracja ryby przez te zarodniki zajmuje tylko kilka sekund. W ciągu pięciu minut worek komórek zarodkowych zwany sporoplazmą wnika do naskórka ryby , aw ciągu kilku godzin sporoplazma dzieli się na pojedyncze komórki, które rozprzestrzenią się w rybie.
W rybie, zarówno wewnątrzkomórkowe, jak i zewnątrzkomórkowe stadia rozmnażają się w chrząstce przez bezpłciową endogenię , co oznacza, że nowe komórki wyrastają ze starych komórek. Ostatnim etapem w obrębie ryby jest wytworzenie myksospory, którą tworzy sporogonia . Są uwalniane do środowiska, gdy ryba rozkłada się lub jest zjadana. Niektóre ostatnie badania wskazują, że niektóre ryby mogą wydalać żywe myksospory, gdy są jeszcze żywe.
Myxospory są niezwykle wytrzymałe: „wykazano, że zarodniki Myxobolus cerebralis mogą tolerować zamrażanie w -20°C przez co najmniej 3 miesiące, starzenie się w błocie w 13°C przez co najmniej 5 miesięcy i przechodzenie przez jelita szczupaka północnego Esox lucius lub krzyżówki Anas platyrhynchos bez utraty zakaźności” na robaki. Triactinomyxons żyją znacznie krócej, przeżywają 34 dni lub krócej, w zależności od temperatury.
Patologia

Zakażenia M. cerebralis zostały zgłoszone przez szeroki zakres gatunków łososiowatych: osiem gatunków "atlantyckich" łososiowatych, Salmo ; cztery gatunki łososiowatych „pacyficznych”, Oncorhynchus ; cztery gatunki golców, Salvelinus ; lipień, Thymallus thymallus ; i głowacica, Hucho hucho . M. cerebralis powoduje uszkodzenia rybich żywicieli poprzez przyczepienie się zarodników triaktynomiksonów i migracje różnych stadiów przez tkanki i wzdłuż nerwów, a także poprzez trawienie chrząstki. Ogon ryby może ciemnieć, ale poza zmianami na chrząstce, narządy wewnętrzne na ogół wydają się zdrowe. Inne objawy obejmują deformacje szkieletu i zachowanie „wirowania” (pogoń za ogonem) u młodych ryb, które uważano za spowodowane utratą równowagi, ale w rzeczywistości jest spowodowane uszkodzeniem rdzenia kręgowego i dolnego pnia mózgu. Eksperymenty wykazały, że ryby mogą zabijać Myxobolus w swojej skórze (prawdopodobnie za pomocą przeciwciał ), ale ryby nie atakują pasożytów po ich migracji do ośrodkowego układu nerwowego. Ta reakcja różni się w zależności od gatunku.
U T. tubifex uwolnienie zarodników triaktynomiksonów ze ściany jelita uszkadza błonę śluzową robaka ; może się to zdarzyć tysiące razy u jednego robaka i uważa się, że zaburza wchłanianie składników odżywczych. Zarodniki są uwalniane z robaka prawie wyłącznie, gdy temperatura wynosi od 10 °C do 15 °C, więc ryby w cieplejszych lub chłodniejszych wodach są mniej podatne na zarażenie, a wskaźniki infekcji zmieniają się sezonowo.
Podatność
Rozmiar ryb, wiek, koncentracja zarodników triaktynomiksonów i temperatura wody wpływają na wskaźniki infekcji u ryb, podobnie jak gatunki ryb, o których mowa. Choroba ma największy wpływ na ryby w wieku poniżej pięciu miesięcy, ponieważ ich szkielety nie uległy skostnieniu . To sprawia, że młode ryby są bardziej podatne na deformacje i dostarczają M. cerebralis więcej chrząstki do żerowania. W jednym badaniu siedmiu gatunków wielu szczepów, pstrąg potokowy i pstrąg tęczowy (z wyjątkiem jednego szczepu) były znacznie silniej dotknięte przez M. cerebralis po dwóch godzinach ekspozycji niż inne gatunki, podczas gdy pstrąg byk , łosoś chinook , pstrąg potokowy i Najmniej ucierpiało lipień arktyczny . Chociaż pstrąg potokowy może być nosicielem pasożyta, zazwyczaj nie wykazuje żadnych objawów, a ten gatunek mógł być pierwotnym żywicielem M. cerebralis . Ten brak objawów u pstrąga potokowego oznaczał, że pasożyta odkryto dopiero po wprowadzeniu do Europy nierodzimych pstrągów tęczowych.
Diagnoza
Umiarkowane lub ciężkie kliniczne zakażenie ryb z wirującą chorobą może być wstępnie zdiagnozowane na podstawie zmian w zachowaniu i wyglądzie około 35 do 80 dni po początkowym zakażeniu, chociaż „uraz lub niedobór dietetycznego tryptofanu i kwasu askorbinowego może wywoływać podobne objawy”, więc rozstrzygająca diagnoza może wymagać znalezienia myksospor w chrząstce ryby. W ciężkich infekcjach, aby znaleźć zarodniki, konieczne może być jedynie badanie mikroskopowe chrząstki. W lżejszych infekcjach najczęstszy test obejmuje trawienie chrząstki czaszki proteazami pepsyną i trypsyną (trawienie pepsyną-trypsyną – PTD) przed poszukiwaniem zarodników. Głowę i inne tkanki można dalej badać za pomocą histopatologii, aby potwierdzić, czy lokalizacja i morfologia zarodników odpowiada temu, co wiadomo o M. cerebralis . Możliwa jest również serologiczna identyfikacja zarodników w skrawkach tkankowych przy użyciu przeciwciała przeciwko zarodnikom. Tożsamość pasożyta można również potwierdzić stosując reakcję łańcuchową polimerazy w celu amplifikacji genu 18S rRNA o długości 415 par zasad z M. cerebralis . Ryby powinny być badane na etapie życia najbardziej podatnym na pasożyty, ze szczególnym uwzględnieniem ryb w jednostkach akwakultury.
Uderzenie

Chociaż początkowo był to łagodny patogen Salmo trutta w Europie Środkowej i innych łososiowatych w północno-wschodniej Azji, wprowadzenie pstrąga tęczowego ( Oncorhynchus mykiss ) znacznie zwiększyło oddziaływanie tego pasożyta. Nie posiadając wrodzonej odporności na M. cerebralis , pstrąg tęczowy jest szczególnie podatny i może uwalniać tak wiele zarodników, że nawet bardziej odporne gatunki na tym samym obszarze, takie jak S. trutta , mogą zostać przeciążone pasożytami i spowodować 80%-90% śmiertelności . Tam, gdzie M. cerebralis zadomowił się, spowodował spadek lub nawet eliminację całych kohort ryb.
Wpływ w Europie
Wpływ M. cerebralis w Europie jest nieco mniejszy, ponieważ gatunek ten jest endemiczny w tym regionie, co daje rodzimym gatunkom ryb pewien stopień odporności . Pstrąg tęczowy, gatunek najbardziej podatny na tego pasożyta, nie pochodzi z Europy; pomyślnie rozmnażające się populacje zdziczałych są rzadkie, więc niewiele dzikich pstrągów tęczowych jest wystarczająco młodych, aby być podatnymi na infekcję. Z drugiej strony są szeroko hodowane do zarybiania wód przeznaczonych do wędkarstwa sportowego i do akwakultury , gdzie ten pasożyt ma największy wpływ. Metody wylęgu i hodowli mające na celu zapobieganie zarażeniu narybku pstrąga tęczowego okazały się skuteczne w Europie. Techniki te obejmują wylęganie jaj w wodzie wolnej od zarodników i hodowlę narybku do etapu „kostnienia” w zbiornikach lub na bieżniach. Metody te zwracają szczególną uwagę na jakość źródeł wody w celu ochrony przed wprowadzeniem zarodników podczas wymiany wody. Narybek przenosi się do stawów ziemnych dopiero wtedy, gdy zostanie uznany za klinicznie odporny na pasożyta, po wystąpieniu kostnienia szkieletu.
Wpływ w Nowej Zelandii
M. cerebralis po raz pierwszy znaleziono w Nowej Zelandii w 1971 roku. Pasożyta znaleziono tylko w rzekach na Wyspie Południowej, z dala od najważniejszych miejsc akwakultury. Ponadto gatunki ryb łososiowatych hodowane komercyjnie w Nowej Zelandii mają niską podatność na chorobę wirową, a pasożyt nie ma również wpływu na rodzime łososiowate. Ważnym pośrednim efektem obecności pasożytów jest ograniczenie kwarantanny na eksport produktów z łososia do Australii.
Wpływ w Stanach Zjednoczonych

M. cerebralis został po raz pierwszy odnotowany w Ameryce Północnej w 1956 r. w Pensylwanii , został wprowadzony przez zarażonego pstrąga importowanego z Europy i stale rozprzestrzeniał się na południe i zachód. Do lat 90. wirowa choroba była uważana za problem, który można rozwiązać, dotykając pstrąga tęczowego w wylęgarniach. Jednak ostatnio zadomowił się w naturalnych wodach stanów Gór Skalistych ( Kolorado , Wyoming , Utah , Montana , Idaho , Nowy Meksyk ), gdzie powoduje ciężką śmiertelność w kilku rzekach przeznaczonych do wędkarstwa sportowego. Niektóre strumienie w zachodnich Stanach Zjednoczonych straciły 90% pstrąga. Ponadto wirowa choroba zagraża rybołówstwu rekreacyjnemu, co jest ważne dla przemysłu turystycznego, kluczowego elementu gospodarek niektórych zachodnich stanów USA. Na przykład „ Montana Whirling Disease Task Force oszacowała, że połowy pstrąga wygenerowały 300 000 000 USD wydatków na rekreację w samej tylko Montanie”. Co gorsza, niektóre gatunki ryb, które M. cerebralis infekuje ( troć , Łosoś Clarka i Steelhead ) są już zagrożone lub zagrożone , a pasożyt może pogorszyć i tak już trudnej sytuacji. Z powodów, które są słabo poznane, ale prawdopodobnie mają związek z warunkami środowiskowymi, wpływ na zakażone ryby był największy w Kolorado i Montanie, a najmniej w Kalifornii , Michigan i Nowym Jorku.
Wpływ w Kanadzie
Choroba wirowa została po raz pierwszy wykryta u ryb w Johnson Lake w Parku Narodowym Banff w maju 2016 r. Laboratorium CFIA potwierdziło w sierpniu, a Parks Canada ogłosiło wybuch epidemii 23 sierpnia 2016 r. Chociaż po raz pierwszy odkryto ją w Banff, niekoniecznie powstałe i rozpowszechnione. Rząd Alberty obecnie pobiera i testuje ryby w 6 różnych zlewniach (Rzeka Pokoju, Athabasca, Północna Saskatchewan, Red Deer, Bow i Oldman), aby sprawdzić, gdzie choroba się rozprzestrzeniła. Wstępne próbki ryb zostały pobrane w 2016 r. i są obecnie przetwarzane przez laboratoria rządu Alberty i CFIA. Odkąd rozpoczęto testy, wykryto ją w rzece Upper Bow River, a w maju 2017 r. potwierdzono, że wirowa choroba została wykryta również w dorzeczu rzeki Oldman. Deklaracja nie oznacza, że każda podatna populacja ryb w zlewniach rzeki Bow i Oldman jest zarażona chorobą.
W wyniku nowej deklaracji wymagane będzie zezwolenie CFIA na przemieszczanie w kraju dla gatunków wrażliwych i zastosowań końcowych zidentyfikowanych w Krajowym Programie Kontroli Przemieszczenia, wektora Tubifex tubifex , czynnika chorobotwórczego Myxobolus cerebralis i/lub podobnych rzeczy. zainfekowanych i buforowych obszarów Alberty. Wędkarstwo rekreacyjne i sportowe, w tym wędkarstwo prowadzone przez profesjonalnego przewodnika, nie wymaga zezwolenia CFIA.
Zapobieganie i kontrola
Niektórzy biolodzy próbowali rozbroić zarodniki triaktynomiksonów, powodując ich przedwczesne odpalenie. W laboratorium tylko ekstremalna kwasowość lub zasadowość , umiarkowane lub wysokie stężenia soli lub prąd elektryczny powodowały przedwczesne wyładowanie żarnika; neurochemikalia, chemosensybilizatory parzydełkowate i śluz pstrąga były nieskuteczne, podobnie jak uśpione lub martwe ryby. Gdyby zarodniki mogły zostać rozbrojone, nie byłyby w stanie zainfekować ryb, ale potrzebne są dalsze badania, aby znaleźć skuteczne leczenie.
Niektóre odmiany ryb są bardziej odporne niż inne, nawet w obrębie gatunku; stosowanie opornych szczepów może pomóc w zmniejszeniu częstości występowania i nasilenia choroby wirowej w akwakulturze. Istnieją również pewne poszlakowe dowody na to, że populacje ryb mogą z czasem rozwinąć odporność na tę chorobę. Ponadto akwakulturyści mogą uniknąć infekcji M. cerebralis , nie używając ziemnych stawów do hodowli młodych ryb; to trzyma je z dala od potencjalnie zakażonych tubificidów i ułatwia eliminację zarodników i skąposzczetów poprzez filtrację, chlorowanie i bombardowanie promieniowaniem ultrafioletowym. Aby zminimalizować populacje tubyfikowatych, techniki obejmują okresową dezynfekcję stawów wylęgarni lub akwakultury oraz hodowlę małych pstrągów w pomieszczeniach, w wodzie wolnej od patogenów. Gładki beton lub bieżnie wyłożone tworzywem sztucznym, które są utrzymywane w czystości i wolne od skażonej wody, chronią obiekty akwakultury przed chorobą.
Na koniec wykazano , że niektóre leki, takie jak furazolidon , furokson , benomyl , fumagillin , proguanil i clamoksychina , hamują rozwój zarodników, co zmniejsza częstość infekcji. Na przykład jedno z badań wykazało, że podawanie fumagiliny O. mykiss zmniejszyło liczbę zarażonych ryb z 73% do 100% do 10% do 20%. Niestety, to leczenie jest uważane za nieodpowiednie dla populacji dzikich pstrągów, a żadne leczenie farmakologiczne nigdy nie okazało się skuteczne w badaniach wymaganych do zatwierdzenia przez Amerykańską Agencję ds . Żywności i Leków .
Wędkarze rekreacyjni i sportowi mogą pomóc w zapobieganiu rozprzestrzenianiu się pasożyta, nie przenosząc ryb z jednego akwenu do drugiego, nie wyrzucając rybich ości ani wnętrzności do żadnego akwenu wodnego oraz upewniając się, że buty i buty są czyste przed przemieszczaniem się między różnymi ciałami Z wody. Należy przestrzegać przepisów federalnych, stanowych, prowincjonalnych i lokalnych dotyczących używania przynęty .
Zobacz też
- Ceratomyxa shasta – kolejny patogenny myksosporynowy pasożyt ryb łososiowatych
- Zakaźna anemia łososia (ISA) – infekcja wirusowa łososia atlantyckiego
- Tyrysyty kudoa – myksosporyny pasożyt wielu gatunków, który po śmierci powoduje upłynnienie tkanek ryb
- Tetracapsuloides bryosalmonae – tajemnicza myksosporyna powodująca „rozrostową chorobę nerek” u ryb łososiowatych
- Podatność łososiowatych na chorobę wirową
Uwagi
Zewnętrzne linki
- Raport Światowej Organizacji Handlu w sprawie australijskich ograniczeń importu łososia
- Inicjatywa Whirling Disease
- Wirujące mapy chorób i dane
- Profil gatunkowy – choroba wirowa ( Myxobolus cerebralis ) , Narodowe Centrum Informacji o Gatunkach Inwazyjnych, Narodowa Biblioteka Rolnicza Stanów Zjednoczonych , zawiera ogólne informacje i zasoby dotyczące choroby wirowej
- Whirling Disease - Park Narodowy Yellowstone (US National Park Service)
- Wirująca choroba – zatrzymaj autostopowiczów wodnych
- Wirująca choroba - Wydział Zasobów Dzikiej Przyrody w Utah
- Colorado Parks & Wildlife - Choroba wirowa i pstrąg w Kolorado
- Co to jest choroba wirowa? - Regionalne Centrum Akwakultury Północno-Centralnej - Mohamed Faisal - Donald Garling
- Wirująca choroba | Alberta.ca



