Rozproszone zapalenie oskrzelików - Diffuse panbronchiolitis
| Rozproszone zapalenie oskrzelików | |
|---|---|
 | |
| Obrazy tomografii komputerowej o wysokiej rozdzielczości dolnej części klatki piersiowej u 16-letniego chłopca z rozlanym zapaleniem oskrzelików | |
| Specjalność | Pulmonologia |
Rozlane zapalenie oskrzelików ( DPB ) jest zapalną chorobą płuc o nieznanej przyczynie. Jest to ciężka, postępująca postać zapalenia oskrzelików , stanu zapalnego oskrzelików (małych dróg oddechowych w płucach). Termin rozlany oznacza, że zmiany chorobowe pojawiają się w obu płucach, podczas gdy zapalenie oskrzelików panbronchiolitis odnosi się do stanu zapalnego występującego we wszystkich warstwach oskrzelików oddechowych (związanych z wymianą gazową ). DPB powoduje ciężkie stany zapalne i guzkowate zmiany w końcowych oskrzelikach , przewlekłe zapalenie zatok i intensywny kaszel z dużą ilością plwociny .
Uważa się, że choroba występuje, gdy istnieje podatność lub brak odporności układu odpornościowego na bakterie lub wirusy wywołujące DPB , spowodowane przez kilka genów, które występują głównie u osób pochodzenia wschodnioazjatyckiego . Najwyższa zachorowalność występuje wśród Japończyków , a następnie Koreańczyków . DPB występuje częściej u mężczyzn i zwykle zaczyna się w wieku około 40 lat. Został uznany za odrębną nową chorobę we wczesnych latach sześćdziesiątych i został formalnie nazwany rozlanym zapaleniem oskrzelików w 1969 roku.
Nieleczony DPB prowadzi do rozstrzenia oskrzeli , nieodwracalnego stanu płuc, który obejmuje powiększenie oskrzelików i gromadzenie się śluzu w drogach oskrzelikowych. Codzienne leczenie DPB antybiotykami makrolidowymi, takimi jak erytromycyna, łagodzi objawy i wydłuża czas przeżycia, ale obecnie nie ma znanego lekarstwa na tę chorobę. Ostatecznym wynikiem DPB może być niewydolność oddechowa i problemy z sercem.
Klasyfikacja
Termin „zapalenie oskrzelików” ogólnie odnosi się do zapalenia oskrzelików. DPB jest klasyfikowany jako forma „pierwotnego zapalenia oskrzelików”, co oznacza, że podstawowa przyczyna zapalenia oskrzelików pochodzi z oskrzelików lub jest ograniczona do oskrzelików. Wraz z DPB, dodatkowe formy podstawowej oskrzelików obejmują zarostowe zapalenie oskrzelików , pęcherzyków, zapalenie oskrzelików, zapalenie oskrzelików oddechowych , mineralny choroby dróg oddechowych pyłów i wielu innych. W przeciwieństwie do DPB, zapalenie oskrzelików, które nie jest uważane za „pierwotne”, może być związane z chorobami większych dróg oddechowych, takimi jak przewlekłe zapalenie oskrzeli .
objawy i symptomy
Objawy DPB obejmują przewlekłe zapalenie zatok (zapalenie zatok przynosowych ), świszczący oddech, trzaski ( szmery oddechowe wydawane przez zatory, takie jak flegma i wydzieliny w płucach), duszność (duszność) i silny kaszel, który powoduje duże ilości plwociny (kaszel -up flegma). W plwocinie może znajdować się ropa , a osoby dotknięte chorobą mogą mieć gorączkę. Typowe objawy progresji DPB obejmują rozszerzenie (powiększenie) dróg oskrzelikowych i hipoksemię (niski poziom tlenu we krwi). Jeśli DPB nie będzie leczony, wystąpi rozstrzenie oskrzeli; charakteryzuje się rozszerzeniem i pogrubieniem ścian oskrzelików, zapaleniem oskrzelików oddechowych i końcowych oraz gromadzeniem się śluzu w płucach. DPB wiąże się z postępującą niewydolnością oddechową , hiperkapnią (podwyższonym poziomem dwutlenku węgla we krwi) i może ostatecznie prowadzić do nadciśnienia płucnego (wysokiego ciśnienia krwi w żyle płucnej i tętnicy ) oraz serca płucnego (rozszerzenie prawej komory serca). lub „prawokomorowa niewydolność serca”).
Przyczyna
DPB jest idiopatyczny , co oznacza, że dokładna fizjologiczna , środowiskowa lub patogenna przyczyna choroby jest nieznana. Podejrzewa się jednak, że z jej patogenezą (sposobem działania choroby) ma związek kilka czynników .
Głównego kompleksu zgodności tkankowej (MHC) jest duża genomowego regionu w większości kręgowców , które są związane z systemem immunologicznym. Znajduje się na chromosomie 6 u ludzi. Podgrupą MHC u ludzi jest ludzki antygen leukocytów (HLA), który kontroluje układ prezentujący antygen , jako część adaptacyjnej odporności przeciwko patogenom, takim jak bakterie i wirusy . Kiedy komórki ludzkie są zakażone patogenem, niektóre z nich mogą prezentować części białek patogenu na swoich powierzchniach; nazywa się to „prezentacją antygenu”. Zakażone komórki stają się następnie celem dla typów cytotoksycznych komórek T , które zabijają zakażone komórki, aby można je było usunąć z organizmu.
Genetyczne predyspozycje do podatności na DPB zostały zlokalizowane w dwóch haplotypach HLA ( różnica w sekwencji nukleotydów lub genów między sparowanymi chromosomami , która jest bardziej prawdopodobna wśród wspólnego pochodzenia etnicznego lub cechy) wspólnych dla osób pochodzenia wschodnioazjatyckiego. HLA-B54 jest związany z DPB u Japończyków, podczas gdy HLA-A11 jest związany z chorobą u Koreańczyków. Uważa się, że kilka genów w tym regionie HLA klasy I jest odpowiedzialnych za DPB, umożliwiając zwiększoną podatność na chorobę. W poszukiwaniu genu DPB uwzględniono wspólne podłoże genetyczne i podobieństwa w profilu HLA dotkniętych nią osób z Japonii i Korei. Zasugerowano, że mutacja genu podejrzewanej podatności na chorobę, zlokalizowanego gdzieś pomiędzy HLA-B i HLA-A, wystąpiła na chromosomie przodków, zawierającym zarówno HLA-B54, jak i HLA-A11. Ponadto jest możliwe, że szereg zdarzeń rekombinacji genetycznej wokół locus choroby (umiejscowienie na chromosomie) mogło spowodować, że choroba była związana z HLA-B54 u Japończyków i HLA-A11 u Koreańczyków. Po dalszych badaniach stwierdzono, że gen podatności na DPB znajduje się w pobliżu locus HLA-B na chromosomie 6p21.3. Na tym obszarze trwają poszukiwania genetycznej przyczyny choroby.
Ponieważ wiele genów należących do HLA pozostaje niezidentyfikowanych, klonowanie pozycyjne (metoda stosowana do identyfikacji określonego genu, gdy znane jest tylko jego położenie na chromosomie) zostało użyte do ustalenia, czy gen mucyny jest powiązany z DPB. Ponadto zbadano choroby wywoływane przez zidentyfikowane geny HLA w regionie podatności na DPB. Jeden z nich, zespół nagich limfocytów I (BLS I), wykazuje szereg podobieństw do DPB u osób dotkniętych chorobą, w tym przewlekłe zapalenie zatok, zapalenie oskrzelików i guzki oraz obecność H. influenzae . Podobnie jak DPB, BLS I reaguje korzystnie na terapię erytromycyną, wykazując ustąpienie objawów. Podobieństwa między tymi dwiema chorobami, odpowiadający im sukces przy takim samym sposobie leczenia oraz fakt, że gen odpowiedzialny za BLS I znajduje się w obszarze HLA wywołującym DPB, zawęża ustalenie genu odpowiedzialnego za DPB. Uważa się, że czynniki środowiskowe, takie jak wdychanie toksycznych oparów i palenie papierosów, nie odgrywają roli w DPB, a nieznane przyczyny środowiskowe i inne niegenetyczne - takie jak niezidentyfikowane bakterie lub wirusy - nie zostały wykluczone.
Mukowiscydoza (CF), postępująca wieloukładowa choroba płuc, była brana pod uwagę w poszukiwaniu genetycznej przyczyny DPB. Dzieje się tak z kilku powodów. CF, podobnie jak DPB, powoduje ciężkie zapalenie płuc, obfite wytwarzanie śluzu, infekcje i wykazuje przewagę genetyczną wśród rasy białej z jednej grupy geograficznej w stosunku do rzadkości innych; podczas gdy DPB dominuje wśród mieszkańców Azji Wschodniej, CF dotyka głównie osoby pochodzenia europejskiego. Chociaż żaden gen nie został uznany za przyczynę DPB, mutacja w określonym genie - znacznie bardziej prawdopodobna u Europejczyków - powoduje mukowiscydozę. Ta mutacja w genie wywołującym CF nie jest czynnikiem DPB, ale wiadomo , że unikalny polimorfizm (zmienność) tego genu występuje u wielu Azjatów, niekoniecznie dotkniętych żadną chorobą. Badane jest, czy ten gen w jakimkolwiek stanie mutacji może przyczynić się do DPB.
Patofizjologia
Zapalenie jest normalną częścią ludzkiej odpowiedzi immunologicznej, w wyniku której leukocyty (białe krwinki), w tym neutrofile (białe krwinki, które specjalizują się w wywoływaniu stanu zapalnego), gromadzą się i chemokiny (białka uwalniane z pewnych komórek, które aktywują lub wywołują odpowiedź inne komórki) gromadzą się w dowolnym miejscu organizmu, w którym występują infekcje bakteryjne lub wirusowe. Zapalenie zaburza aktywność bakterii i wirusów i służy do ich usunięcia z organizmu. W DPB bakterie takie jak Haemophilus influenzae i Pseudomonas aeruginosa mogą powodować proliferację komórek zapalnych w tkankach oskrzelików. Jednak, gdy żadna z bakterii nie jest obecna w DPB, stan zapalny trwa z jeszcze nieznanego powodu. W obu przypadkach stan zapalny w DPB może być tak poważny, że w ścianach oskrzelików tworzą się guzki zawierające komórki zapalne. Obecność stanu zapalnego i infekcji dróg oddechowych powoduje również wytwarzanie nadmiaru śluzu, który należy odkrztusić w postaci plwociny. Połączenie stanu zapalnego, rozwoju guzków, infekcji, śluzu i częstego kaszlu przyczynia się do trudności w oddychaniu w DPB.
Fakt, że stan zapalny w DPB utrzymuje się z obecnością P. aeruginosa i H. influenzae lub bez niej, dostarcza środków do określenia kilku mechanizmów patogenezy DPB. Leukotrieny to eikozanoidy , cząsteczki sygnałowe wykonane z niezbędnych kwasów tłuszczowych , które odgrywają rolę w wielu chorobach płuc, powodując proliferację komórek zapalnych i nadmierną produkcję śluzu w drogach oddechowych. W DPB i innych chorobach płuc dominującym mediatorem zapalenia związanego z neutrofilami jest leukotrien B4 , który specjalizuje się w proliferacji neutrofili poprzez chemotaksję (przemieszczanie się niektórych typów komórek do lub od pewnych cząsteczek).
Zapalenie w DPB jest również spowodowane chemokiną MIP-1alfa i jej zaangażowaniem w limfocyty T CD8 + . Beta defensyny , rodzina peptydów przeciwdrobnoustrojowych występujących w drogach oddechowych, są odpowiedzialne za dalsze zapalenie DPB, gdy obecny jest patogen, taki jak P. aeruginosa . Jeśli jest obecny w DPB, ludzki wirus limfotropowy T typu I , retrowirus , modyfikuje patogenezę DPB przez infekowanie komórek pomocniczych T i zmianę ich skuteczności w rozpoznawaniu obecności znanych lub nieznanych patogenów związanych z DPB.
Diagnoza
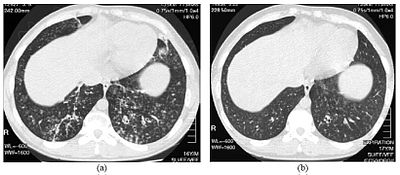
Rozpoznanie DPB wymaga analizy płuc i tkanek oskrzelików, co może wymagać biopsji płuc lub bardziej preferowanego skanowania płuc za pomocą tomografii komputerowej o wysokiej rozdzielczości (HRCT). Kryteria diagnostyczne obejmują ciężkie zapalenie we wszystkich warstwach oskrzelików oddechowych i zmiany w tkance płucnej, które pojawiają się jako guzki w końcowych i oddechowych oskrzelikach w obu płucach. Guzki w DPB wyglądają jak nieprzezroczyste grudki, gdy są oglądane na zdjęciu rentgenowskim płuc i mogą powodować niedrożność dróg oddechowych , którą ocenia się za pomocą testu czynności płuc lub PFT. Rentgen płuc może również ujawnić rozszerzenie dróg oskrzelikowych, kolejny objaw DPB. Skany HRCT często wykazują zablokowanie niektórych dróg oskrzelikowych przez śluz, co jest określane jako wzór „drzewa w pąku” . Niedotlenienie, kolejna oznaka trudności w oddychaniu, ujawnia się poprzez pomiar zawartości tlenu i dwutlenku węgla we krwi za pomocą badania krwi zwanego gazometrią krwi tętniczej . Inne odkrycia obserwowane w przypadku DPB obejmują proliferację limfocytów ( białych krwinek zwalczających infekcję), neutrofili i piankowatych histiocytów ( makrofagów tkankowych ) w wyściółce płuc . Wykrywane są również bakterie, takie jak H. influenzae i P. aeruginosa , przy czym ta ostatnia staje się coraz bardziej widoczna w miarę postępu choroby. Białą krew, zawartość bakterii i innych komórek we krwi można zmierzyć, wykonując pełną morfologię krwi (CBC). Można zauważyć podwyższone poziomy IgG i IgA (klasy immunoglobulin ), a także obecność czynnika reumatoidalnego (wskaźnik autoimmunizacji ). Może również wystąpić hemaglutynacja , zlepianie się czerwonych krwinek w odpowiedzi na obecność przeciwciał we krwi. Neutrofile, beta-defensyny, leukotrieny i chemokiny można również wykryć w płynie z popłuczyn oskrzelowo-pęcherzykowych wstrzykniętym, a następnie usuniętym z dróg oddechowych oskrzelikowych osób z DPB w celu oceny.
Diagnostyka różnicowa
W diagnostyce różnicowej (znajdowaniu prawidłowej diagnozy między chorobami, które mają wspólne cechy) niektórych obturacyjnych chorób płuc, często bierze się pod uwagę DPB. Szereg objawów DPB przypomina te występujące przy innych obturacyjnych chorobach płuc, takich jak astma , przewlekłe zapalenie oskrzeli i rozedma . Świszczący oddech , kaszel z wydzielaniem plwociny i duszność są częstymi objawami w takich chorobach, a obturacyjne upośledzenie czynności układu oddechowego stwierdza się w testach czynności płuc . Mukowiscydoza, podobnie jak DPB, powoduje ciężkie zapalenie płuc, nadmierną produkcję śluzu i infekcję; ale DPB nie powoduje zaburzeń trzustki ani elektrolitów , podobnie jak mukowiscydoza, więc te dwie choroby są różne i prawdopodobnie nie są ze sobą powiązane. DPB wyróżnia się obecnością zmian chorobowych, które pojawiają się na zdjęciu rentgenowskim jako guzki w oskrzelikach obu płuc; zapalenie wszystkich warstw tkankowych oskrzelików oddechowych; i jego większe rozpowszechnienie wśród osób z rodowodem wschodnioazjatyckim.
DPB i zarostowe zapalenie oskrzelików to dwie formy pierwotnego zapalenia oskrzelików. Specyficzne, nakładające się cechy obu chorób obejmują silny kaszel z dużą ilością plwociny, często wypełnionej ropą; guzki widoczne na zdjęciu rentgenowskim płuc w dolnych oskrzelach i okolicy oskrzelikowej; i przewlekłe zapalenie zatok. W DPB guzki są bardziej ograniczone do oskrzelików oddechowych, podczas gdy w OB często znajdują się w błoniastych oskrzelikach (początkowa niechrzęstna sekcja oskrzelików, która oddziela oskrzela trzeciorzędowe ) aż do oskrzela wtórnego . OB to choroba oskrzelikowa występująca na całym świecie, podczas gdy DPB ma częstsze występowanie, głównie w Japonii. Przed klinicznym rozpoznaniem DPB w ostatnich latach często był on błędnie diagnozowany jako rozstrój oskrzeli , POChP , IPF , gruźlica prosówkowa , sarkoidoza lub rak pęcherzyków płucnych .
Leczenie
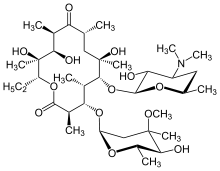
Antybiotyki makrolidowe , takie jak erytromycyna , są skutecznym sposobem leczenia DPB, jeśli są przyjmowane regularnie przez dłuższy czas. Powszechnie stosuje się również klarytromycynę lub roksytromycynę . Pomyślne wyniki makrolidów w DPB i podobnych chorobach płuc wynikają z leczenia niektórych objawów poprzez immunomodulację (dostosowanie odpowiedzi immunologicznej), którą można osiągnąć, przyjmując antybiotyki w małych dawkach . Leczenie polega na codziennym doustnym podawaniu erytromycyny przez dwa do trzech lat, przez dłuższy okres, który, jak wykazano, radykalnie poprawia działanie DPB. Jest to widoczne, gdy osoba poddawana leczeniu DPB, spośród wielu kryteriów remisji związanych z chorobą, ma prawidłową liczbę neutrofili wykrytą w płynie BAL i gazometrii ( badanie krwi tętniczej, które mierzy ilość tlenu i dwutlenku węgla w blood) pokazują, że poziom wolnego tlenu we krwi mieści się w normalnym zakresie. Zaproponowano tymczasowe przerwanie leczenia erytromycyną w tych przypadkach, aby zmniejszyć powstawanie opornych na makrolidy P. aeruginosa . Jednak objawy DPB zwykle powracają i konieczne byłoby wznowienie leczenia. Chociaż erytromycyna jest wysoce skuteczna, może nie okazać się skuteczna u wszystkich osób z tą chorobą, zwłaszcza jeśli obecna jest oporna na makrolidy P. aeruginosa lub wcześniej nieleczona DPB rozwinęła się do punktu, w którym występuje niewydolność oddechowa.
Z erytromycyną terapii w DPB, duże zmniejszenie zapalenia i uszkodzenia oskrzelikowego uzyskuje się poprzez stłumienie nie tylko neutrofili proliferacji, ale również aktywność limfocytów i obturacyjnych śluzu i wodnych wydzielin w drogach oddechowych. Antybiotykowe działanie makrolidów nie jest związane z ich korzystnym wpływem na zmniejszenie stanu zapalnego DPB. Jest to oczywiste, ponieważ dawka lecznicza jest o wiele za mała, aby zwalczyć infekcję, aw przypadkach DPB z występowaniem P. aeruginosa opornych na makrolidy terapia erytromycyną nadal zmniejsza stan zapalny.
W hamowaniu stanu zapalnego przez erytromycynę i inne makrolidy bierze udział szereg czynników. Szczególnie skutecznie hamują proliferację neutrofili, zmniejszając zdolność przyciągania interleukiny 8 i leukotrienu B4 . Makrolidy zmniejszają również skuteczność cząsteczek adhezyjnych, które umożliwiają neutrofilom przyleganie do wyściółek tkanek oskrzelików. Wytwarzanie śluzu w drogach oddechowych jest głównym winowajcą zachorowalności i śmiertelności DPB i innych chorób układu oddechowego. Znaczące zmniejszenie stanu zapalnego DPB przypisywanego terapii erytromycyną pomaga również hamować wytwarzanie nadmiaru śluzu.
Rokowanie
Nieleczona DPB prowadzi do rozstrzeni oskrzeli, niewydolności oddechowej i śmierci. W raporcie z 1983 roku stwierdzono, że nieleczona DPB miała pięcioletni wskaźnik przeżycia 62,1%, podczas gdy 10-letni wskaźnik przeżycia wynosił 33,2%. Dzięki leczeniu erytromycyną osoby z DPB mają teraz znacznie dłuższą oczekiwaną długość życia dzięki lepszemu leczeniu objawów, opóźnieniu progresji i zapobieganiu towarzyszącym infekcjom, takim jak P. aeruginosa . 10-letnie przeżycie dla leczonej DPB wynosi około 90%. W przypadkach DPB, w których leczenie przyniosło znaczną poprawę, co czasami ma miejsce po około dwóch latach, pozwolono na przerwanie leczenia na pewien czas. Jednak osoby, którym pozwolono zaprzestać leczenia w tym czasie, są ściśle monitorowane. Ponieważ udowodniono nawrót DPB, leczenie erytromycyną należy niezwłocznie wznowić, gdy objawy choroby zaczną się ponownie pojawiać. Pomimo lepszych rokowań po leczeniu, DPB nie ma obecnie znanego lekarstwa.
Epidemiologia
DPB ma najwyższą częstość występowania wśród Japończyków - 11 na 100 000 mieszkańców. Zgłaszano również przypadki tej choroby u Koreańczyków, Chińczyków i Tajów. Sugeruje się predyspozycje genetyczne wśród mieszkańców Azji Wschodniej. Choroba występuje częściej u mężczyzn, a stosunek mężczyzn do kobiet wynosi 1,4–2: 1 (lub około 5 mężczyzn do 3 kobiet). Średni początek choroby to około 40 lat, a dwie trzecie dotkniętych nią osób to osoby niepalące, chociaż uważa się, że palenie nie jest jej przyczyną. Obecność HLA-Bw54 zwiększa 13,3-krotnie ryzyko rozlanego zapalenia oskrzelików.
W Europie i obu Amerykach stosunkowo niewielką liczbę przypadków DPB odnotowano u imigrantów i mieszkańców Azji, a także u osób pochodzenia spoza Azji. Na Zachodzie doszło do błędnej diagnozy ze względu na mniejszą rozpoznawalność choroby niż w krajach azjatyckich. W porównaniu z dużą liczbą Azjatów żyjących na zachodzie, niewielka liczba z nich, jak się uważa, jest dotknięta DPB, sugeruje, że czynniki niegenetyczne mogą odgrywać pewną rolę w jej przyczynie. Ta rzadkość obserwowana u mieszkańców Azji Zachodniej może być również częściowo związana z błędną diagnozą.
Historia
We wczesnych latach sześćdziesiątych lekarze w Japonii zaobserwowali i opisali stosunkowo nową przewlekłą chorobę płuc. W 1969 r. Wprowadzono nazwę „rozlane zapalenie oskrzelików”, aby odróżnić je od przewlekłego zapalenia oskrzeli, rozedmy płuc, zapalenia pęcherzyków płucnych i innych obturacyjnych chorób płuc przebiegających z zapaleniem. W latach 1978-1980 wyniki ogólnokrajowego badania zainicjowanego przez Ministerstwo Zdrowia i Opieki Społecznej Japonii ujawniły ponad 1000 prawdopodobnych przypadków DPB, z których 82 potwierdzono histologicznie. W latach osiemdziesiątych XX wieku została rozpoznana na całym świecie jako odrębna choroba płuc.
Przed rokiem 1980 rokowanie lub oczekiwany wynik DPB były złe, zwłaszcza w przypadkach nadkażenia (pojawienie się nowej infekcji wirusowej lub bakteryjnej, oprócz obecnie występującej infekcji) przez P. aeruginosa . DPB nadal miał bardzo wysoki wskaźnik śmiertelności, zanim uogólnione leczenie antybiotykami i tlenoterapia zaczęły być rutynowo stosowane w celu opanowania objawów. Około 1985 r., Kiedy długoterminowe leczenie antybiotykiem erytromycyną stało się standardem postępowania w DPB, rokowanie znacznie się poprawiło. W 1990 roku początkowo twierdzono, że DPB ma związek z HLA.
Bibliografia
Linki zewnętrzne
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |