Dichroizm kołowy - Circular dichroism
Dichroizm kołowy ( CD ) to dichroizm obejmujący światło spolaryzowane kołowo , tj. różnicową absorpcję światła lewostronnego i prawoskrętnego . Światło spolaryzowane kołowo w lewo (LHC) i kołowo w prawo (RHC) reprezentuje dwa możliwe stany spinowego momentu pędu dla fotonu, a zatem dichroizm kołowy jest również określany jako dichroizm dla spinowego momentu pędu. Zjawisko to odkryli Jean-Baptiste Biot , Augustin Fresnel i Aimé Cotton w pierwszej połowie XIX wieku. Dichroizm kołowy i dwójłomność kołowa są przejawami aktywności optycznej . Jest wystawiony na pasmach absorpcji z optycznie czynnych chiralnych cząsteczek. Spektroskopia CD ma szerokie zastosowanie w wielu różnych dziedzinach. Przede wszystkim UV CD jest używany do badania struktury drugorzędowej białek. UV/Vis CD służy do badania przejść z przeniesieniem ładunku . CD w bliskiej podczerwieni jest wykorzystywane do badania struktury geometrycznej i elektronicznej poprzez badanie przejść metalicznych d → d . Wibracyjny dichroizm kołowy , który wykorzystuje światło z obszaru energii podczerwonej , jest wykorzystywany do badań strukturalnych małych cząsteczek organicznych, a ostatnio białek i DNA.
Zasady fizyczne
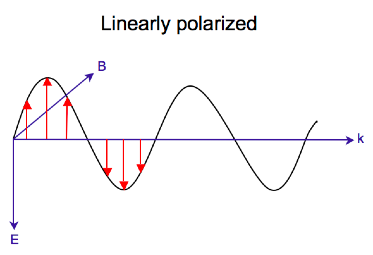
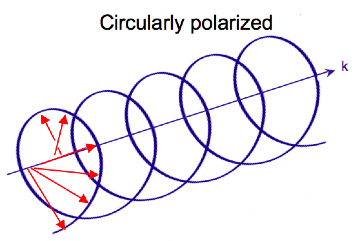
Polaryzacja kołowa światła
Promieniowanie elektromagnetyczne składa się z pola elektrycznego i magnetycznego, które oscylują prostopadle do siebie i do kierunku propagacji, fala poprzeczna . Podczas gdy światło spolaryzowane liniowo występuje, gdy wektor pola elektrycznego oscyluje tylko w jednej płaszczyźnie, światło spolaryzowane kołowo pojawia się, gdy kierunek wektora pola elektrycznego obraca się wokół jego kierunku propagacji, podczas gdy wektor zachowuje stałą wielkość. W jednym punkcie przestrzeni, kołowo spolaryzowany wektor wykreśli okrąg w jednym okresie częstotliwości fali, stąd nazwa. Dwa wykresy poniżej pokazują wektory pola elektrycznego światła spolaryzowanego liniowo i kołowo, w jednym momencie czasu, dla szeregu pozycji; wykres kołowo spolaryzowanego wektora elektrycznego tworzy spiralę wzdłuż kierunku propagacji . Dla światła spolaryzowanego kołowo w lewo (LCP) z propagacją w kierunku obserwatora wektor elektryczny obraca się w kierunku przeciwnym do ruchu wskazówek zegara . W przypadku światła spolaryzowanego kołowo w prawo (RCP), wektor elektryczny obraca się zgodnie z ruchem wskazówek zegara.
Oddziaływanie kołowo spolaryzowanego światła z materią
Gdy światło spolaryzowane kołowo przechodzi przez absorbujący ośrodek optycznie czynny, prędkości pomiędzy polaryzacją prawą i lewą różnią się ( ), jak również długość ich fali ( ) oraz stopień ich pochłaniania ( ). Różnica polega na dichroizmie kołowym . Pole elektryczne wiązki światła powoduje liniowe przesunięcie ładunku podczas oddziaływania z cząsteczką ( dipol elektryczny ), natomiast jej pole magnetyczne powoduje cyrkulację ładunku ( dipol magnetyczny ). Te dwa połączone ruchy powodują wzbudzenie elektronu w ruchu śrubowym, który obejmuje translację i obrót oraz związane z nimi operatory . Wyznaczoną doświadczalnie zależność między siłą obrotową próbki a siłą wyraża się wzorem
Wytrzymałość obrotowa została również wyznaczona teoretycznie,
Widzimy z tych dwóch równań, że aby mieć wartość niezerową , operatory momentu dipolowego elektrycznego i magnetycznego ( i ) muszą zostać przekształcone jako ta sama nieredukowalna reprezentacja . i są jedynymi grupami punktowymi, w których może to nastąpić, powodując, że aktywne są tylko chiralne cząsteczki CD.
Mówiąc prościej, ponieważ samo spolaryzowane kołowo światło jest „chiralne”, inaczej oddziałuje z cząsteczkami chiralnymi . Oznacza to, że dwa rodzaje światła spolaryzowanego kołowo są pochłaniane w różnym stopniu. W eksperymencie CD, równe ilości lewego i prawego kołowo spolaryzowanego światła o wybranej długości fali są naprzemiennie wypromieniowywane do (chiralnej) próbki. Jedna z dwóch polaryzacji jest absorbowana bardziej niż druga i mierzy się tę zależną od długości fali różnicę absorpcji, otrzymując widmo CD próbki. Ze względu na interakcję z cząsteczką wektor pola elektrycznego światła po przejściu przez próbkę wytycza eliptyczną ścieżkę.
Ważne jest, aby chiralność cząsteczki była raczej konformacyjna niż strukturalna. Oznacza to, że na przykład cząsteczka białka o spiralnej strukturze drugorzędowej może mieć CD, które zmienia się wraz ze zmianami konformacji.
Absorbancja delta
Zgodnie z definicją,
gdzie (Absorbancja Delta) jest różnicą pomiędzy absorbancją światła spolaryzowanego kołowo w lewo (LCP) i światła spolaryzowanego kołowo w prawo (RCP) (jest to zwykle mierzone). jest funkcją długości fali , więc aby pomiar był miarodajny, musi być znana długość fali, przy której został wykonany.
Molowy dichroizm kołowy
Można to również wyrazić, stosując prawo Beera , jako:
gdzie
- i są molowymi współczynnikami ekstynkcji dla światła LCP i RCP,
- jest stężenie molowe ,
- to długość ścieżki w centymetrach (cm).
Następnie
jest molowy dichroizm kołowy. Ta wewnętrzna właściwość jest zwykle rozumiana przez dichroizm kołowy substancji. Ponieważ jest funkcją długości fali, molowa wartość dichroizmu kołowego ( ) musi określać długość fali, przy której jest ważna.
Zewnętrzny wpływ na dichroizm kołowy
W wielu praktycznych zastosowaniach dichroizmu kołowego (CD), jak omówiono poniżej, mierzona CD nie jest po prostu wewnętrzną właściwością cząsteczki, ale raczej zależy od konformacji cząsteczki. W takim przypadku CD może również być funkcją temperatury, stężenia i środowiska chemicznego, w tym rozpuszczalników. W takim przypadku podana wartość CD musi również określać te inne istotne czynniki, aby była istotna.
W uporządkowanych strukturach pozbawionych podwójnej symetrii obrotowej aktywność optyczna, w tym transmisja różnicowa (i odbicie) fal spolaryzowanych kołowo, zależy również od kierunku propagacji przez materiał. W tym przypadku tzw. zewnętrzna chiralność 3d związana jest z wzajemną orientacją wiązki światła i struktury.
Eliptyczność trzonowców
Chociaż zwykle jest mierzony, ze względów historycznych większość pomiarów podaje się w stopniach eliptyczności. Eliptyczność trzonowców to dichroizm kołowy skorygowany o koncentrację. Molowy dichroizm kołowy i molowy eliptyczność , łatwo przekonwertować za pomocą równania:
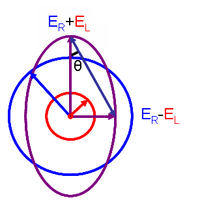
Zależność tę wyprowadza się definiując eliptyczność polaryzacji jako:
gdzie
- i są wielkościami wektorów pola elektrycznego światła spolaryzowanego kołowo w prawo i w lewo kołowo.
Gdy równa się (gdy nie ma różnicy w absorbancji światła spolaryzowanego kołowo w prawo iw lewo), wynosi 0° i światło jest spolaryzowane liniowo . Gdy albo albo jest równe zeru (gdy całkowita absorbancja światła spolaryzowanego kołowo w jednym kierunku), wynosi 45° i światło jest spolaryzowane kołowo .
Generalnie efekt dichroizmu kołowego jest mały, więc jest mały i może być przybliżony jak w radianach . Ponieważ intensywność lub irradiancja , , światła jest proporcjonalna do kwadratu wektora pola elektrycznego, eliptyczność staje się:
Następnie zastępując I używając prawa Beera w postaci logarytmu naturalnego :
Eliptyczność można teraz zapisać jako:
Ponieważ , wyrażenie to można aproksymować, rozszerzając wykładniki w szeregu Taylora do pierwszego rzędu, a następnie odrzucając wyrazy z w porównaniu z jednością i konwertując z radianów na stopnie:
Liniowa zależność stężenia substancji rozpuszczonej i długości drogi jest usuwana poprzez zdefiniowanie eliptyczności molowej jako,
Następnie łącząc dwa ostatnie wyrażenia z prawem Beera , eliptyczność molowa staje się:
Jednostki eliptyki molowej to historycznie (deg·cm 2 /dmol). Aby obliczyć eliptyczność molową, należy znać stężenie próbki (g/l), długość ścieżki komórkowej (cm) i masę cząsteczkową (g/mol).
Jeśli próbka jest białkiem, średnia masa reszt (średnia masa cząsteczkowa reszt aminokwasowych, które zawiera) jest często stosowana zamiast masy cząsteczkowej, zasadniczo traktując białko jako roztwór aminokwasów. Zastosowanie średniej eliptyczności reszt ułatwia porównanie CD białek o różnej masie cząsteczkowej; użycie tej znormalizowanej CD jest ważne w badaniach struktury białek.
Średnia eliptyczność pozostałości
Sposoby szacowania struktury drugorzędowej w polimerach, białkach i polipeptydach, w szczególności, często wymagają przekształcenia zmierzonego widma eliptyczności molowej do wartości znormalizowanej, w szczególności wartości niezależnej od długości polimeru. W tym celu wykorzystywana jest średnia eliptyczność pozostałości; jest to po prostu zmierzona eliptyczność molowa cząsteczki podzielona przez liczbę jednostek monomerowych (reszt) w cząsteczce.
Zastosowanie do cząsteczek biologicznych
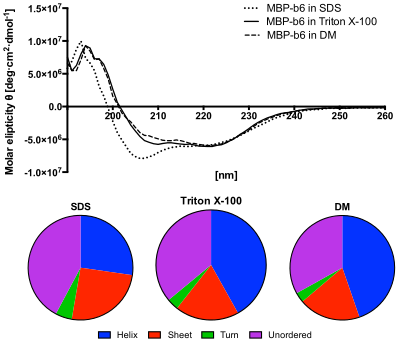
Panel dolny: Zawartość struktur drugorzędowych przewidziana na podstawie widm CD przy użyciu algorytmu CDSSTR. Białko w roztworze SDS wykazuje zwiększoną zawartość struktur nieuporządkowanych i zmniejszoną zawartość helis.
Ogólnie rzecz biorąc, zjawisko to będzie przejawiać się w pasmach absorpcji dowolnej optycznie aktywnej cząsteczki. W konsekwencji dichroizm kołowy wykazują cząsteczki biologiczne, ze względu na ich składniki prawoskrętne i lewoskrętne . Jeszcze ważniejsze jest to, że struktura drugorzędowa będzie również nadawać odrębną CD swoim odpowiednim cząsteczkom. Dlatego też, helisa alfa białka i podwójna spirala z kwasów nukleinowych mają podpisów Przedstawiciela cD Spectral struktur. Zdolność CD do nadania reprezentatywnej sygnatury strukturalnej sprawia, że jest to potężne narzędzie we współczesnej biochemii z zastosowaniami, które można znaleźć w praktycznie każdej dziedzinie badań.
CD jest ściśle związany z techniką optycznej dyspersji rotacyjnej (ORD) i jest ogólnie uważany za bardziej zaawansowaną. CD mierzy się w lub w pobliżu pasm absorpcyjnych cząsteczki będącej przedmiotem zainteresowania, podczas gdy ORD można mierzyć daleko od tych pasm. Przewaga CD jest widoczna w analizie danych. Elementy strukturalne są wyraźniej rozróżniane, ponieważ ich zarejestrowane pasma nie nakładają się w dużym stopniu na poszczególnych długościach fal, jak to ma miejsce w ORD. W zasadzie te dwa pomiary spektralne można przekonwertować poprzez transformację całkową ( zależność Kramersa-Kroniga ), jeśli wszystkie absorpcje są uwzględnione w pomiarach.
Widmo białek CD w dalekim UV ( ultrafiolet ) może ujawnić ważne cechy ich struktury drugorzędowej . Widma CD można łatwo wykorzystać do oszacowania frakcji cząsteczki, która jest w konformacji alfa-helisy, konformacji beta-kartki, konformacji beta-zwrotu lub innej konformacji (np. kłębka nieuporządkowanego). Te ułamkowe przypisania nakładają ważne ograniczenia na możliwe drugorzędowe konformacje, w których może znajdować się białko. CD nie może ogólnie powiedzieć, gdzie wykryte alfa helisy znajdują się w cząsteczce, ani nawet całkowicie przewidzieć, ile ich jest. Mimo to płyta CD jest cennym narzędziem, zwłaszcza do pokazywania zmian w budowie. Można go na przykład wykorzystać do badania zmian struktury drugorzędowej cząsteczki w funkcji temperatury lub stężenia środków denaturujących, np. chlorku guanidyniowego lub mocznika . W ten sposób może ujawnić ważne informacje termodynamiczne o cząsteczce (takie jak entalpia i energia swobodna denaturacji Gibbsa ), których nie można łatwo uzyskać w inny sposób. Każdy, kto spróbuje zbadać białko, uzna CD za cenne narzędzie do weryfikacji, czy białko jest w swojej natywnej konformacji, przed podjęciem z nim rozległych i/lub kosztownych eksperymentów. Istnieje również wiele innych zastosowań spektroskopii CD w chemii białek, niezwiązanych z szacowaniem frakcji alfa-helisowej. Ponadto spektroskopia CD została wykorzystana w badaniach interfejsów bionieorganicznych. W szczególności zastosowano go do analizy różnic w strukturze drugorzędowej zmodyfikowanego białka przed i po miareczkowaniu odczynnikiem.
Widmo CD w zakresie bliskiego UV (>250 nm) białek dostarcza informacji o strukturze trzeciorzędowej . Uzyskane w obszarze 250-300 nm sygnały ze względu na absorpcję, orientację dipoli i charakteru otoczenia z (albo SS, fenyloalanina, tyrozyna, cysteina mostków dwusiarczkowych ) i tryptofanu, aminokwasy . W przeciwieństwie do CD dalekiego UV, widma CD bliskiego UV nie można przypisać do żadnej konkretnej struktury 3D. Widma CD bliskie UV dostarczają raczej informacji strukturalnych o naturze grup protetycznych w białkach, np. grup hemowych w hemoglobinie i cytochromiec .
Widoczna spektroskopia CD jest bardzo potężną techniką do badania interakcji metal-białko i może rozróżniać poszczególne przejścia elektronowe d-d jako oddzielne pasma. Widma CD w obszarze światła widzialnego są wytwarzane tylko wtedy, gdy jon metalu znajduje się w środowisku chiralnym, a zatem wolne jony metali w roztworze nie są wykrywane. Ma to tę zaletę, że obserwuje się tylko metal związany z białkiem, dzięki czemu można łatwo uzyskać zależność od pH i stechiometrię. Aktywność optyczną kompleksów jonów metali przejściowych przypisano efektom konfiguracyjnym, konformacyjnym i wicynalnym. Klewpatinond i Viles (2007) stworzyli zestaw reguł empirycznych do przewidywania pojawienia się widzialnych widm CD dla kwadratowo-planarnych kompleksów Cu 2+ i Ni 2+ obejmujących koordynację histydyny i łańcucha głównego.
CD daje mniej specyficzne informacje strukturalne niż krystalografia rentgenowska i spektroskopia NMR białek , które dają dane o rozdzielczości atomowej. Spektroskopia CD to jednak szybka metoda, która nie wymaga dużych ilości białek ani intensywnego przetwarzania danych. Tak więc CD może być używany do badania dużej liczby warunków rozpuszczalnika , różnej temperatury , pH , zasolenia i obecności różnych kofaktorów.
Spektroskopia CD jest zwykle stosowana do badania białek w roztworze, a zatem uzupełnia metody badania stanu stałego. Jest to również ograniczenie, ponieważ wiele białek jest osadzonych w błonach w stanie natywnym, a roztwory zawierające struktury błonowe są często silnie rozpraszane. CD jest czasami mierzone w cienkich warstwach.
CD spektroskopia zostało również wykonane przy użyciu materiałów półprzewodnikowych takich jak TiO 2 w celu uzyskania dużych sygnałów w zakresie długości fal UV, gdzie często występują przejścia elektroniczne biomolekuł.
Ograniczenia eksperymentalne
CD badano również w węglowodanach , ale z ograniczonym powodzeniem ze względu na trudności doświadczalne związane z pomiarem widm CD w obszarze widma próżniowego ultrafioletu (VUV) (100–200 nm), gdzie znajdują się odpowiednie pasma CD niepodstawionych węglowodanów . Z powodzeniem zmierzono podstawione węglowodany z prążkami powyżej regionu VUV.
Pomiar CD komplikuje również fakt, że typowe wodne układy buforowe często absorbują w zakresie, w którym cechy strukturalne wykazują zróżnicowaną absorpcję światła spolaryzowanego kołowo. Bufory fosforanowe , siarczanowe , węglanowe i octanowe są generalnie niekompatybilne z CD, chyba że zostaną ekstremalnie rozcieńczone, np. w zakresie 10-50 mM. System buforowy TRIS należy całkowicie unikać podczas odtwarzania płyt dalekiego UV. Związki boranowe i oniowe są często używane do ustalenia odpowiedniego zakresu pH dla eksperymentów CD. Niektórzy eksperymentatorzy zastąpili jon chlorkowy fluorem, ponieważ fluor absorbuje mniej w dalekim UV, a niektórzy pracowali w czystej wodzie. Inną, prawie uniwersalną techniką jest zminimalizowanie absorpcji rozpuszczalnika poprzez zastosowanie komórek o krótszych długościach ścieżki podczas pracy w dalekim UV, długość ścieżki 0,1 mm nie jest rzadkością w tej pracy.
Oprócz pomiarów w układach wodnych, CD, szczególnie CD w dalekim UV, można mierzyć w rozpuszczalnikach organicznych, np. etanolu, metanolu, trifluoroetanolu (TFE). Ta ostatnia ma tę zaletę, że indukuje tworzenie struktury białek, indukując beta-kartki w niektórych i alfa helisy w innych, czego nie byłyby widoczne w normalnych warunkach wodnych. Większość powszechnych rozpuszczalników organicznych, takich jak acetonitryl , THF , chloroform , dichlorometan jest jednak niekompatybilna z dalekim UV CD.
Warto zauważyć, że widma CD białka stosowane do oceny struktury drugorzędowej są związane z absorpcją orbitalną π do π* wiązań amidowych łączących aminokwasy. Te pasma absorpcji leżą częściowo w tak zwanym ultrafiolecie próżniowym (długości fal poniżej około 200 nm). Interesujący obszar długości fali jest w rzeczywistości niedostępny w powietrzu z powodu silnej absorpcji światła przez tlen przy tych długościach fal. W praktyce widma te są mierzone nie w próżni, ale w beztlenowym instrumencie (wypełnionym czystym gazowym azotem ).
Po wyeliminowaniu tlenu, być może drugim najważniejszym czynnikiem technicznym w pracy poniżej 200 nm jest zaprojektowanie reszty systemu optycznego tak, aby miał niskie straty w tym regionie. Krytyczne pod tym względem jest zastosowanie zwierciadeł aluminizowanych, których powłoki zostały zoptymalizowane pod kątem niskich strat w tym zakresie widma.
Typowym źródłem światła w tych instrumentach jest wysokociśnieniowa lampa ksenonowa o krótkim łuku . Zwykłe lampy ksenonowe łukowe nie nadają się do stosowania w niskim UV. Zamiast tego należy stosować specjalnie skonstruowane lampy z osłonami wykonanymi z syntetycznej topionej krzemionki o wysokiej czystości .
Światło ze źródeł synchrotronowych ma znacznie wyższy strumień przy krótkich długościach fal i zostało użyte do nagrywania płyt CD do 160 nm. W 2010 roku spektrofotometr CD w ośrodku przechowywania elektronów ISA na Uniwersytecie w Aarhus w Danii został użyty do rejestracji widm CD w stanie stałym do 120 nm. Na poziomie mechaniki kwantowej gęstość cech dichroizmu kołowego i skręcalności optycznej jest identyczna. Dyspersja optyczna i dichroizm kołowy mają tę samą zawartość informacji kwantowych .
Zobacz też
Bibliografia
Zewnętrzne linki
- Spektroskopia dichroizmu kołowego firmy Alliance Protein Laboratories, komercyjnego dostawcy usług
- Wprowadzenie do spektroskopii dichroizmu kołowego przez Applied Photophysics, dostawcę sprzętu
- Animowany samouczek „krok po kroku” na temat dichroizmu kołowego i rotacji optycznej autorstwa prof. Valeva.
























![{\displaystyle [\theta]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1456b03b038385e3bc52344dbf1a9bfbc41b4cf)
![[\theta] = 3298.2\,\Delta \varepsilon.\,](https://wikimedia.org/api/rest_v1/media/math/render/svg/c66e42a40570e3d3cb312c0eadd95d59170dc258)











![{\ Displaystyle [\ theta] = {\ Frac {100 \ theta} {Cl}} \,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ec21d26e0b12e81313ef0b42bbb5ec4f63369c3d)
![[\theta]= 100 \,\Delta \varepsilon \left( \frac {\ln 10}{4} \right) \left( \frac {180}{\pi} \right) = 3298.2\,\Delta \ varepsilon \,](https://wikimedia.org/api/rest_v1/media/math/render/svg/88756c2cb3877d28ff0932ef432b0a5e4861ab58)