Diagnostyka wspomagana komputerowo - Computer-aided diagnosis
| Diagnostyka wspomagana komputerowo | |
|---|---|
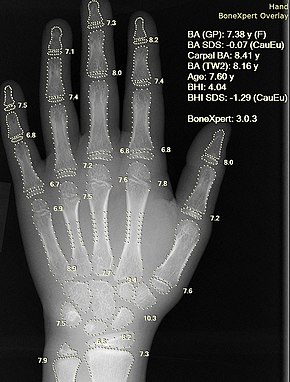
Zdjęcie rentgenowskie ręki z automatycznym obliczeniem wieku kostnego przez oprogramowanie komputerowe.
| |
| Cel, powód | komputerowa pomoc diagnostyka obrazów, |
Wykrywanie wspomagane komputerowo ( CADe ), zwane również diagnostyką wspomaganą komputerowo ( CADx ), to systemy, które pomagają lekarzom w interpretacji obrazów medycznych . Techniki obrazowania w diagnostyce rentgenowskiej , rezonansu magnetycznego i ultrasonografii dostarczają wielu informacji, które radiolog lub inny personel medyczny musi przeanalizować i kompleksowo ocenić w krótkim czasie. Systemy CAD przetwarzają obrazy cyfrowe w celu uzyskania typowego wyglądu i podświetlenia widocznych fragmentów, takich jak możliwe choroby, w celu zaoferowania danych wejściowych wspierających decyzję podjętą przez profesjonalistę.
CAD ma również potencjalne przyszłe zastosowania w patologii cyfrowej wraz z pojawieniem się algorytmów obrazowania całych slajdów i uczenia maszynowego . Do tej pory jego zastosowanie ograniczało się do ilościowego oznaczania immunobarwienia, ale jest również badane pod kątem standardowego barwienia H&E .
CAD to interdyscyplinarna technologia łącząca elementy sztucznej inteligencji i wizji komputerowej z przetwarzaniem obrazów radiologicznych i patologicznych . Typowym zastosowaniem jest wykrywanie guza. Na przykład niektóre szpitale wykorzystują CAD do wspierania profilaktycznych badań lekarskich w mammografii (diagnoza raka piersi), wykrywania polipów w okrężnicy i raka płuc .
Systemy wykrywania wspomaganego komputerowo (CADe) są zwykle ograniczone do oznaczania widocznych konstrukcji i sekcji. Systemy diagnostyki wspomaganej komputerowo (CADx) oceniają widoczne struktury. Na przykład w mammografii CAD podkreśla skupiska mikrozwapnień i hipergęste struktury w tkance miękkiej. Pozwala to radiologowi wyciągnąć wnioski na temat stanu patologii. Innym zastosowaniem jest CADq, które określa ilościowo np . wielkość guza lub zachowanie guza w wychwytywaniu środka kontrastowego. Komputerowo wspomagany prosty triage (CAST) to inny rodzaj CAD, który przeprowadza w pełni automatyczną wstępną interpretację i segregację badań na pewne znaczące kategorie ( np. negatywne i pozytywne). CAST ma szczególne zastosowanie w diagnostyce obrazowej w nagłych wypadkach, gdzie wymagana jest szybka diagnoza stanu krytycznego, zagrażającego życiu.
Chociaż CAD jest używany w środowiskach klinicznych od ponad 40 lat, CAD zwykle nie zastępuje lekarza ani innego specjalisty, ale raczej odgrywa rolę pomocniczą. Profesjonalista (zazwyczaj radiolog) jest generalnie odpowiedzialny za ostateczną interpretację obrazu medycznego. Jednak celem niektórych systemów CAD jest wykrycie najwcześniejszych objawów nieprawidłowości u pacjentów, których nie mogą wykonać specjaliści, jak w przypadku retinopatii cukrzycowej , zniekształceń architektonicznych w mammogramach, guzków matowej szyby w tomografii komputerowej klatki piersiowej oraz zmian niepolipowatych („płaskich”). w kolonografii CT.
Tematy
Krótka historia
Pod koniec lat pięćdziesiątych, wraz z nadejściem współczesnych komputerów, badacze z różnych dziedzin zaczęli badać możliwości budowy systemów komputerowego wspomagania diagnostyki medycznej (CAD). Te pierwsze systemy CAD wykorzystywały schematy blokowe, dopasowywanie wzorców statystycznych, teorię prawdopodobieństwa lub bazy wiedzy do kierowania procesem podejmowania decyzji.
Od wczesnych lat siedemdziesiątych, niektóre z bardzo wczesnych systemów CAD w medycynie, które często były określane jako „ systemy eksperckie ” w medycynie, były opracowywane i wykorzystywane głównie do celów edukacyjnych. Mycin system ekspercki The -I Internist system ekspercki i laski (system ekspercki) są niektóre z tych przykładów.
Na początku wczesnych prac rozwojowych badacze dążyli do zbudowania całkowicie zautomatyzowanych systemów CAD/eksperckich. Oczekiwania, co komputery mogą zrobić, były nierealistycznie optymistyczne wśród tych naukowców. Jednak po przełomowej pracy Richarda M. Karpa „Reducibility between Combinatorial Problems” stało się jasne, że istnieją ograniczenia, ale także potencjalne możliwości, gdy opracowuje się algorytmy do rozwiązywania grup ważnych problemów obliczeniowych.
W wyniku nowego zrozumienia różnych ograniczeń algorytmicznych, które Karp odkrył na początku lat 70., naukowcy zaczęli zdawać sobie sprawę z poważnych ograniczeń, jakie mają CAD i systemy ekspertowe w medycynie. Rozpoznanie tych ograniczeń skłoniło badaczy do opracowania nowych rodzajów systemów CAD przy użyciu zaawansowanych podejść. Dlatego pod koniec lat 80. i na początku lat 90. skupiono się na wykorzystaniu metod eksploracji danych w celu korzystania z bardziej zaawansowanych i elastycznych systemów CAD.
W 1998 roku pierwszy komercyjny system CAD do mammografii, system ImageChecker, został zatwierdzony przez amerykańską Agencję ds. Żywności i Leków (FDA). W kolejnych latach kilka komercyjnych systemów CAD do analizy mammografii, rezonansu magnetycznego piersi, obrazowania medycznego płuc, okrężnicy i serca również otrzymało aprobaty FDA. Obecnie systemy CAD są wykorzystywane jako pomoc diagnostyczna, aby zapewnić lekarzom lepsze podejmowanie decyzji medycznych.
Metodologia
CAD jest zasadniczo oparty na bardzo złożonym rozpoznawaniu wzorów . Obrazy rentgenowskie lub inne rodzaje obrazów są skanowane w poszukiwaniu podejrzanych struktur. Zwykle do optymalizacji algorytmu wymagane jest kilka tysięcy obrazów. Cyfrowe dane obrazu są kopiowane na serwer CAD w formacie DICOM i są przygotowywane i analizowane w kilku krokach.
1. Wstępne przetwarzanie dla
- Redukcja artefaktów (błędów w obrazach)
- Redukcja szumów obrazu
- Wyrównywanie (harmonizacja) jakości obrazu (podwyższony kontrast) w celu oczyszczenia różnych podstawowych warunków obrazu, np. różnych parametrów ekspozycji.
- Filtracja
2. Segmentacja dla
- Różnicowanie różnych struktur na obrazie, np. serce, płuco, klatka piersiowa, naczynia krwionośne, możliwe zmiany okrągłe
- Dopasowanie do bazy danych anatomicznych
- Przykładowe wartości szarości w objętości zainteresowania
3. Analiza struktury/ROI (obszaru zainteresowania) Każdy wykryty region jest analizowany indywidualnie pod kątem specjalnych cech:
- Ścisłość
- Forma, rozmiar i lokalizacja
- Odniesienie do obiektów znajdujących się w pobliżu / ROI
- Analiza średniej wartości szarości w ramach ROI
- Proporcja poziomów szarości do granicy struktury wewnątrz ROI
4. Ocena / klasyfikacja Po analizie struktury każdy ROI jest oceniany indywidualnie (scoring) pod kątem prawdopodobieństwa TP. Poniższe procedury są przykładami algorytmów klasyfikacji.
- Reguła najbliższego sąsiada (np. k -najbliżsi sąsiedzi )
- Klasyfikator minimalnej odległości
- Klasyfikator kaskadowy
- Naiwny klasyfikator bayesowski
- Sztuczna sieć neuronowa
- Radialna sieć funkcji bazowych (RBF)
- Maszyna wektorów nośnych (SVM)
- Analiza głównych składników (PCA)
Jeśli wykryte struktury osiągnęły określony poziom progowy, są one podświetlane na obrazie dla radiologa. W zależności od systemu CAD oznaczenia te można zapisać na stałe lub tymczasowo. Zaletą tego ostatniego jest to, że zapisywane są tylko znaki zatwierdzone przez radiologa. Fałszywych trafień nie należy zachowywać, ponieważ późniejsze badanie staje się wtedy trudniejsze.
Czułość i specyficzność
Systemy CAD starają się wyróżnić podejrzane struktury. Dzisiejsze systemy CAD nie potrafią wykryć 100% zmian patologicznych. Wskaźnik trafień ( czułość ) może wynosić do 90% w zależności od systemu i aplikacji. Prawidłowe trafienie jest określane jako prawdziwie dodatnie (TP), podczas gdy nieprawidłowe oznaczenie zdrowych części stanowi wynik fałszywie dodatni (FP). Im mniej wskazanych FP, tym wyższa specyficzność . Niska swoistość zmniejsza akceptację systemu CAD, ponieważ użytkownik musi zidentyfikować wszystkie te błędne trafienia. Wskaźnik FP w przeglądowych badaniach płuc (CAD Chest) może zostać zmniejszony do 2 na badanie. W innych segmentach ( np. badania CT płuc) częstość FP może wynosić 25 lub więcej. W systemach CAST wskaźnik FP musi być wyjątkowo niski (mniej niż 1 na badanie), aby umożliwić sensowną selekcję badania .
Bezwzględna wykrywalność
Bezwzględny wskaźnik wykrywalności radiologa jest miarą alternatywną do czułości i swoistości. Ogólnie rzecz biorąc, wyniki badań klinicznych dotyczące czułości, swoistości i bezwzględnego wskaźnika wykrywalności mogą się znacznie różnić. Każdy wynik badania zależy od jego podstawowych warunków i musi być oceniany na tych warunkach. Następujące fakty mają silny wpływ:
- Projektowanie retrospektywne lub prospektywne
- Jakość użytych obrazów
- Stan badania rentgenowskiego
- Doświadczenie i wykształcenie radiologa
- Rodzaj zmiany
- Rozmiar rozważanej zmiany
Wyzwania, przed którymi stoi CAD w medycynie
Pomimo wielu postępów, jakie firma CAD dokonała od zarania komputerów, wciąż istnieją pewne wyzwania, przed którymi stoją dziś systemy CAD.
Niektóre wyzwania są związane z różnymi ograniczeniami algorytmicznymi w procedurach systemu CAD, w tym zbieraniem danych wejściowych, wstępnym przetwarzaniem, przetwarzaniem i oceną systemu. Algorytmy są na ogół zaprojektowane tak, aby wybrać jedną prawdopodobną diagnozę, zapewniając w ten sposób suboptymalne wyniki u pacjentów z wieloma współistniejącymi zaburzeniami. Obecnie dane wejściowe do CAD pochodzą głównie z elektronicznych kart zdrowia (EHR). Skuteczne projektowanie, wdrażanie i analizowanie pod kątem EHR jest główną koniecznością w każdym systemie CAD.
Ze względu na masową dostępność danych i konieczność ich analizy, big data jest również jednym z największych wyzwań, przed jakimi stoją dziś systemy CAD. Poważnym problemem jest coraz większa ilość danych pacjentów. Często dane pacjenta są złożone i mogą być danymi częściowo ustrukturyzowanymi lub nieustrukturyzowanymi . Wymaga wysoce rozwiniętego podejścia do ich przechowywania, wyszukiwania i analizowania w rozsądnym czasie.
Na etapie przetwarzania wstępnego dane wejściowe wymagają normalizacji. Normalizacja danych wejściowych obejmuje redukcję szumów i filtrowanie. Przetwarzanie może obejmować kilka podetapów w zależności od aplikacji. Podstawowe trzy podetapy obrazowania medycznego to segmentacja, ekstrakcja / selekcja cech i klasyfikacja. Te podetapy wymagają zaawansowanych technik analizy danych wejściowych przy krótszym czasie obliczeniowym. Chociaż wiele wysiłku włożono w tworzenie innowacyjnych technik dla tych procedur systemów CAD, wciąż nie ma jednego najlepszego algorytmu dla każdego kroku. Niezbędne są ciągłe badania nad budowaniem innowacyjnych algorytmów dla wszystkich aspektów systemów CAD.
Brakuje również ustandaryzowanych środków oceny systemów CAD. Fakt ten może powodować trudności w uzyskaniu zgody FDA do użytku komercyjnego. Co więcej, chociaż udowodniono wiele pozytywnych osiągnięć systemów CAD, badania mające na celu walidację ich algorytmów w praktyce klinicznej prawie nie zostały potwierdzone.
Inne wyzwania związane są z problemem wdrażania przez świadczeniodawców nowych systemów CAD do praktyki klinicznej. Niektóre negatywne badania mogą zniechęcać do korzystania z CAD. Ponadto brak przeszkolenia pracowników służby zdrowia w zakresie stosowania CAD czasami prowadzi do błędnej interpretacji wyników systemu. Wyzwania te są opisane bardziej szczegółowo w.
Aplikacje

CAD stosowane w diagnostyce raka piersi , raka płuc , raka okrężnicy , raka prostaty , przerzuty do kości , chorobę wieńcową , wrodzonej wady serca , patologiczne mózgu wykrywania wykrywania złamań, choroby Alzheimera i retinopatia cukrzycowa .
Rak piersi
CAD jest stosowany w mammografii przesiewowej (badanie rentgenowskie kobiecej piersi). Mammografia przesiewowa służy do wczesnego wykrywania raka piersi. Systemy CAD są często wykorzystywane do klasyfikowania guza jako złośliwego lub łagodnego. CAD jest szczególnie rozpowszechniony w Stanach Zjednoczonych i Holandii i jest używany jako dodatek do oceny u ludzi, zwykle przez radiologa . Pierwszy system CAD do mammografii został opracowany w ramach projektu badawczego na Uniwersytecie w Chicago. Obecnie jest oferowany komercyjnie przez iCAD i Hologic . Jednakże, pomimo osiągania wysokiej czułości, systemy CAD mają zwykle bardzo niską swoistość, a korzyści z używania CAD pozostają niepewne. Przegląd systematyczny z 2008 r. dotyczący wspomaganego komputerowo wykrywania w mammografii przesiewowej wykazał, że CAD nie ma znaczącego wpływu na wskaźnik wykrywalności raka, ale w sposób niepożądany zwiększa wskaźnik przypominania ( tj . odsetek wyników fałszywie dodatnich). Zauważono jednak znaczną niejednorodność wpływu na wskaźnik przypominania w różnych badaniach.
Ostatnie postępy w dziedzinie uczenia maszynowego , głębokiego uczenia i technologii sztucznej inteligencji umożliwiły opracowanie systemów CAD, które, jak udowodniono klinicznie, pomagają radiologom w sprostaniu wyzwaniom związanym z odczytywaniem obrazów mammograficznych poprzez poprawę wskaźników wykrywalności raka i ograniczenie liczby fałszywych alarmów i niepotrzebnych powtórek pacjentów. znacznie skraca czas czytania.
Istnieją również procedury oceny mammografii oparte na obrazowaniu metodą rezonansu magnetycznego .
Rak płuc (rak oskrzeli)
W diagnostyce raka płuca tomografia komputerowa ze specjalnymi trójwymiarowymi systemami CAD jest ustalana i uznawana za właściwą drugą opinię. Na tym etapie przygotowuje się i analizuje wolumetryczny zestaw danych zawierający do 3000 pojedynczych obrazów. Wykrywalne są zmiany okrągłe ( rak płuca , przerzuty i zmiany łagodne) od 1 mm. Obecnie wszyscy znani dostawcy systemów medycznych oferują odpowiednie rozwiązania.
Cenne jest wczesne wykrycie raka płuca. Jednak losowe wykrycie raka płuca we wczesnym stadium (stadium 1) na zdjęciu rentgenowskim jest trudne. Okrągłe zmiany, które różnią się od 5–10 mm, są łatwo przeoczone. Rutynowe stosowanie CAD Chest Systems może pomóc w wykryciu niewielkich zmian bez początkowego podejrzenia. Wielu badaczy opracowało systemy CAD do wykrywania guzków w płucach (okrągłe zmiany mniejsze niż 30 mm) w radiografii klatki piersiowej i CT oraz systemy CAD do diagnozowania ( np. rozróżniania złośliwych i łagodnych) guzków płucnych w CT. Wirtualne obrazowanie dwuenergetyczne poprawiło wydajność systemów CAD w radiografii klatki piersiowej.
Rak okrężnicy
CAD jest dostępny do wykrywania polipów jelita grubego w okrężnicy w kolonografii CT. Polipy to małe narośla wyrastające z wewnętrznej wyściółki okrężnicy. CAD wykrywa polipy, identyfikując ich charakterystyczny kształt przypominający guzek. Aby uniknąć nadmiernych wyników fałszywie dodatnich, CAD ignoruje normalną ścianę okrężnicy, w tym fałdy brzuszne .
Choroba sercowo-naczyniowa
Najnowocześniejsze metody obliczeń sercowo-naczyniowych, informatyki sercowo-naczyniowej oraz modelowania matematycznego i obliczeniowego mogą dostarczyć cennych narzędzi w podejmowaniu decyzji klinicznych. Systemy CAD z nowatorskimi markerami opartymi na analizie obrazu jako dane wejściowe mogą pomóc lekarzom naczyniowym w podejmowaniu z większą pewnością decyzji o najlepszym leczeniu pacjentów z chorobami układu krążenia .
Wiarygodne wczesne wykrycie i stratyfikacja ryzyka miażdżycy tętnic szyjnych ma ogromne znaczenie dla przewidywania udarów u pacjentów bezobjawowych. W tym celu zaproponowano różne nieinwazyjne i tanie markery, wykorzystujące cechy oparte na obrazie ultrasonograficznym . Łączą one echogeniczność , teksturę i charakterystykę ruchu, aby pomóc w podjęciu decyzji klinicznej w kierunku lepszego przewidywania, oceny i zarządzania ryzykiem sercowo-naczyniowym.
CAD jest dostępna do automatycznego wykrywania istotnej (powodującej ponad 50% stenozy ) choroby wieńcowej w badaniach angiografii wieńcowej CT (CCTA).
Wrodzona wada serca
Wczesne wykrycie patologii może być różnicą między życiem a śmiercią. CADe można wykonać przez osłuchiwanie za pomocą stetoskopu cyfrowego i specjalistycznego oprogramowania, znanego również jako osłuchiwanie wspomagane komputerowo . Szmery, nieregularne tony serca, spowodowane przepływem krwi przez wadliwe serce, można wykryć z dużą czułością i swoistością. Osłuchiwanie wspomagane komputerowo jest wrażliwe na hałas zewnętrzny i dźwięki ciała, a do prawidłowego funkcjonowania wymaga niemal cichego otoczenia.
Wykrywanie patologicznego mózgu (PBD)
Chaplot i in. jako pierwszy zastosował współczynniki dyskretnej transformacji falkowej (DWT) do wykrywania patologicznych mózgów. Maitra i Chatterjee zastosowali transformację Slantleta, która jest ulepszoną wersją DWT. Ich wektor cech każdego obrazu jest tworzony przez uwzględnienie wielkości wyjściowych transformacji Slantleta odpowiadających sześciu położeniom przestrzennym wybranym zgodnie z określoną logiką.
W 2010 roku Wang i Wu przedstawili metodę opartą na sieci neuronowej (FNN) do klasyfikacji danego obrazu mózgu MR jako normalnego lub nieprawidłowego. Parametry FNN zostały zoptymalizowane za pomocą adaptacyjnej optymalizacji roju cząstek chaotycznych (ACPSO). Wyniki na 160 obrazach wykazały, że dokładność klasyfikacji wyniosła 98,75%.
W 2011 roku Wu i Wang zaproponowali użycie DWT do ekstrakcji cech, PCA do redukcji cech oraz FNN ze skalowaną chaotyczną kolonią sztucznej pszczół (SCABC) jako klasyfikatora.
W 2013 r. Saritha i in. jako pierwsi zastosowali entropię falkową (WE) do wykrywania patologicznych mózgów. Saritha zasugerowała również wykorzystanie wykresów pajęczych. Później Zhang i in. udowodniono, że usunięcie wykresów pajęczych nie wpłynęło na wydajność. Zastosowano metodę wyszukiwania wzorców genetycznych w celu zidentyfikowania nieprawidłowego mózgu od zdrowych osób kontrolnych. Jego dokładność klasyfikacji została zgłoszona na 95,188%. Das i in. zaproponował użycie przekształcenia Rippleta. Zhang i in. zaproponował zastosowanie optymalizacji roju cząstek (PSO). Kalbkhani i in. zasugerował użycie modelu GARCH.
W 2014 roku El-Dahshan i in. zasugerowano użycie sieci neuronowej o sprzężeniu impulsowym.
W 2015 r. Zhou i in. zasugerowano zastosowanie naiwnego klasyfikatora Bayesa do wykrywania patologicznych mózgów.
Choroba Alzheimera
CAD można wykorzystać do identyfikacji osób z chorobą Alzheimera i łagodnymi zaburzeniami poznawczymi od osób z grupy kontrolnej osób starszych.
W 2014 roku Padma i in . wykorzystano połączone statystyczne cechy tekstury falkowej do segmentacji i klasyfikacji skrawków guza łagodnego i złośliwego AD. Zhang i in. stwierdzono, że drzewo decyzyjne maszyny wektorów wsparcia jądra miało 80% dokładność klasyfikacji, ze średnim czasem obliczeń wynoszącym 0,022 s dla każdej klasyfikacji obrazu.
W 2019 r. Signaevsky i in . po raz pierwszy donieśli o wyszkolonej sieci w pełni splotowej (FCN) do wykrywania i ilościowej oceny splątków neurofibrylarnych (NFT) w chorobie Alzheimera i szeregu innych tauopatii. Wyszkolony FCN osiągnął wysoką precyzję i przywołanie w naiwnej segmentacji semantycznej obrazu całego slajdu (WSI), prawidłowo identyfikując obiekty NFT przy użyciu modelu SegNet wytrenowanego dla 200 epok. FCN osiągnął niemal praktyczną wydajność przy średnim czasie przetwarzania wynoszącym 45 minut na WSI na jednostkę przetwarzania graficznego (GPU), umożliwiając niezawodne i powtarzalne wykrywanie NFT na dużą skalę. Zmierzona wydajność na danych testowych ośmiu naiwnych WSI w różnych tauopatiach dała wynik przypomnienia , precyzja i wynik F1 odpowiednio 0,92, 0,72 i 0,81.
Eigenbrain jest nowością mózgu, które mogą pomóc wykryć AD, w oparciu o główny składnik Analiza lub Niezależna analiza składowych rozkładu. Wykazano, że SVM jądra wielomianowego osiąga dobrą dokładność. Wielomianowy KSVM działa lepiej niż liniowy SVM i SVM jądra RBF. Inne podejścia z przyzwoitymi wynikami obejmują wykorzystanie analizy tekstury, cech morfologicznych lub cech statystycznych wyższego rzędu
Medycyna nuklearna
CADx jest dostępny dla obrazów medycyny nuklearnej. Istnieją komercyjne systemy CADx do diagnozowania przerzutów do kości w skanach całego ciała i choroby wieńcowej w obrazach perfuzji mięśnia sercowego.
Przy wysokiej czułości i akceptowalnym wskaźniku wykrywania fałszywych zmian, wspomagany komputerowo system automatycznego wykrywania zmian jest przydatny i prawdopodobnie w przyszłości będzie w stanie pomóc lekarzom medycyny nuklearnej w identyfikowaniu możliwych zmian kostnych.
Retinopatia cukrzycowa
Retinopatia cukrzycowa jest chorobą siatkówki rozpoznawaną głównie na podstawie obrazów dna oka. Pacjenci z cukrzycą w krajach uprzemysłowionych na ogół poddawani są regularnym badaniom przesiewowym. Obrazowanie służy do rozpoznawania wczesnych oznak nieprawidłowych naczyń krwionośnych siatkówki. Ręczna analiza tych obrazów może być czasochłonna i zawodna. CAD został wykorzystany do zwiększenia dokładności, czułości i specyficzności automatycznej metody wykrywania. Stosowanie niektórych systemów CAD w celu zastąpienia równiarek ludzkich może być bezpieczne i opłacalne.
Wstępne przetwarzanie obrazu oraz wyodrębnianie i klasyfikacja cech to dwa główne etapy tych algorytmów CAD.
Metody wstępnego przetwarzania
Normalizacja obrazu minimalizuje zmienność w całym obrazie. Zgłaszano, że zmiany intensywności w obszarach między obwodowym a centralnym obszarem plamki oka powodują niedokładność segmentacji naczyń. Na podstawie przeglądu z 2014 r. ta technika była najczęściej stosowana i pojawiła się w 11 z 40 niedawno (od 2011 r.) opublikowanych badań pierwotnych.
Wyrównanie histogramu jest przydatne do zwiększania kontrastu obrazu. Ta technika służy do zwiększenia lokalnego kontrastu. Pod koniec przetwarzania ciemne obszary na obrazie wejściowym zostaną rozjaśnione, co znacznie zwiększy kontrast między cechami obecnymi w tym obszarze. Z drugiej strony jaśniejsze obszary obrazu wejściowego pozostaną jasne lub ich jasność zostanie zmniejszona w celu wyrównania z innymi obszarami obrazu. Oprócz segmentacji naczyń inne cechy związane z retinopatią cukrzycową można dalej oddzielić za pomocą tej techniki przetwarzania wstępnego. Mikrotętniak i krwotoki są zmianami czerwonymi, natomiast wysięki są plamami żółtymi. Zwiększający się kontrast między tymi dwiema grupami pozwala na lepszą wizualizację zmian na obrazach. Dzięki tej technice przegląd z 2014 r. wykazał, że 10 z 14 niedawno (od 2011 r.) opublikowanych badań pierwotnych.
Inną techniką przydatną w różnicowaniu zmian, a nie naczyń, jest filtrowanie przez zielone kanały . Metoda ta jest ważna, ponieważ zapewnia maksymalny kontrast między zmianami związanymi z retinopatią cukrzycową. Mikrotętniaki i krwotoki to czerwone zmiany, które po zastosowaniu zielonego filtrowania kanałowego stają się ciemne. Natomiast wysięki, które na normalnym obrazie wydają się żółte, po przefiltrowaniu na zielono są przekształcane w jasne białe plamki. Ta technika jest najczęściej stosowana zgodnie z przeglądem z 2014 r., Pojawiła się w 27 z 40 opublikowanych artykułów w ciągu ostatnich trzech lat. Ponadto filtrowanie zielonego kanału może być stosowane do wykrywania środka tarczy optycznej w połączeniu z systemem podwójnego okienka.
Korekcja nierównomiernego oświetlenia to technika, która dostosowuje się do nierównomiernego oświetlenia w obrazie dna oka. Nierównomierne oświetlenie może być potencjalnym błędem w automatycznym wykrywaniu retinopatii cukrzycowej ze względu na zmiany statystycznej charakterystyki obrazu. Zmiany te mogą wpływać na późniejsze przetwarzanie, takie jak ekstrakcja cech, i nie są widoczne dla ludzi. Korekcję nierównomiernego oświetlenia (f') można osiągnąć poprzez modyfikację intensywności pikseli przy użyciu znanej oryginalnej intensywności pikseli (f) i średnich intensywności lokalnych (λ) i pożądanych pikseli (μ) (patrz wzór poniżej). Następnie stosuje się transformację Waltera-Kleina, aby uzyskać równomierne oświetlenie. Ta technika jest najmniej stosowaną metodą przetwarzania wstępnego w przeglądzie z 2014 r.
Operacje morfologiczne są drugą najrzadziej stosowaną metodą przetwarzania wstępnego w przeglądzie z 2014 r. Głównym celem tej metody jest zapewnienie wzmocnienia kontrastu, zwłaszcza ciemniejszych obszarów w porównaniu z tłem.
Wyodrębnianie cech i klasyfikacje
Po wstępnej obróbce obrazu dna oka, obraz będzie dalej analizowany przy użyciu różnych metod obliczeniowych. Jednak aktualna literatura jest zgodna, że niektóre metody są stosowane częściej niż inne podczas analiz segmentacji naczyń. Metody te to SVM, wieloskalowe, śledzenie statków, podejście do rozwoju regionu i podejścia oparte na modelach.
Maszyna wektorów nośnych jest zdecydowanie najczęściej używanym klasyfikatorem w segmentacji naczyń, aż do 90% przypadków. SVM to nadzorowany model uczenia się, który należy do szerszej kategorii techniki rozpoznawania wzorców. Algorytm działa, tworząc największą lukę między różnymi próbkami danych. Celem jest stworzenie jak największej luki między tymi komponentami, która minimalizuje potencjalny błąd w klasyfikacji. Aby skutecznie oddzielić informacje o naczyniach krwionośnych od reszty obrazu oka, algorytm SVM tworzy wektory pomocnicze, które oddzielają piksel naczynia krwionośnego od reszty obrazu w nadzorowanym środowisku. Wykrywanie naczynia krwionośnego z nowych obrazów można przeprowadzić w podobny sposób przy użyciu wektorów pomocniczych. Połączenie z innymi technikami wstępnego przetwarzania, takimi jak filtrowanie w zielonym kanale, znacznie poprawia dokładność wykrywania nieprawidłowości w naczyniach krwionośnych. Niektóre korzystne właściwości SVM obejmują
- Elastyczność – Wysoka elastyczność pod względem funkcji
- Prostota – Prosta, szczególnie w przypadku dużych zbiorów danych (do oddzielenia danych potrzebne są tylko wektory wsparcia)
Podejście wieloskalowe to podejście o wielu rozdzielczościach w segmentacji naczyń. W niskiej rozdzielczości można najpierw wydobyć naczynia o dużej średnicy. Zwiększając rozdzielczość, można łatwo rozpoznać mniejsze gałęzie z dużych naczyń. Dlatego jedną z zalet stosowania tej techniki jest zwiększona szybkość analityczna. Dodatkowo takie podejście można zastosować w przypadku obrazów 3D. Reprezentacja powierzchni to powierzchnia normalna do krzywizny naczyń, umożliwiająca wykrycie nieprawidłowości na powierzchni naczyń.
Śledzenie statków to zdolność algorytmu do wykrywania „linii środkowej” statków. Te linie środkowe są maksymalnym szczytem krzywizny naczynia. Centra naczyń można znaleźć za pomocą informacji kierunkowych, które są dostarczane przez filtr Gaussa. Podobne podejścia, które wykorzystują koncepcję linii środkowej, to oparte na szkielecie i geometrii różniczkowej.
Podejście powiększające region to metoda wykrywania sąsiednich pikseli o podobieństwach. Do rozpoczęcia takiej metody wymagany jest punkt nasion. Do działania tej techniki potrzebne są dwa elementy: podobieństwo i bliskość przestrzenna. Piksel sąsiadujący z pikselem nasion o podobnej intensywności prawdopodobnie będzie tego samego typu i zostanie dodany do regionu wzrostu. Jedną z wad tej techniki jest to, że wymaga ręcznego wyboru punktu początkowego, co wprowadza błąd i niespójność w algorytmie. Ta technika jest również wykorzystywana do identyfikacji dysków optycznych.
Podejścia oparte na modelach wykorzystują reprezentację do wyodrębniania naczyń z obrazów. Znane są trzy szerokie kategorie oparte na modelu: dopasowanie odkształcalne, parametryczne i szablonowe. Metody odkształcalne wykorzystują obiekty, które zostaną odkształcone w celu dopasowania do konturów obiektów na obrazie. Parametric wykorzystuje parametry geometryczne, takie jak cylindryczne, cylindryczne lub elipsoidalne przedstawienie naczyń krwionośnych. Klasyczny kontur węża w połączeniu z informacjami o topologii naczyń krwionośnych można również wykorzystać jako podejście oparte na modelu. Wreszcie, dopasowanie szablonu to użycie szablonu dopasowanego w procesie deformacji stochastycznej przy użyciu trybu 1 ukrytego Markowa.
Wpływ na zatrudnienie
Automatyzacja pracy diagnostyki medycznej (na przykład ilościowego oznaczania czerwonych krwinek ) ma pewien historyczny precedens. Rewolucja głębokiego uczenia się z lat 2010 już zaowocowała sztucznymi inteligencjami, które są dokładniejsze w wielu obszarach diagnostyki wizualnej niż radiolodzy i dermatolodzy, i oczekuje się, że ta luka będzie się powiększać. Niektórzy eksperci, w tym wielu lekarzy, lekceważą wpływ, jaki sztuczna inteligencja będzie miała na specjalizacje medyczne. W przeciwieństwie do tego, wielu ekonomistów i ekspertów w dziedzinie sztucznej inteligencji uważa, że dziedziny takie jak radiologia zostaną masowo zakłócone, z bezrobociem lub presją na obniżenie płac radiologów; szpitale będą potrzebowały mniej radiologów, a wielu nadal istniejących radiologów będzie wymagało znacznego przeszkolenia. Geoffrey Hinton , „ojciec chrzestny głębokiego uczenia się”, twierdzi, że (z uwagi na prawdopodobny postęp oczekiwany w ciągu najbliższych pięciu lub dziesięciu lat) szpitale powinny natychmiast zaprzestać szkolenia radiologów, ponieważ ich czasochłonne i kosztowne szkolenie w zakresie diagnostyki wizualnej zostanie wkrótce zakończone. w większości przestarzałe, co prowadzi do nadmiaru tradycyjnych radiologów. Artykuł w JAMA twierdzi, że patolodzy i radiolodzy powinni połączyć się w jedną rolę „specjalisty ds. informacji” i stwierdzają, że „Aby uniknąć zastąpienia przez komputery, radiolodzy muszą pozwolić, aby komputery ich zastępowały”. Specjaliści ds. informacji zostaliby przeszkoleni w zakresie „logiki bayesowskiej, statystyki, nauki o danych” oraz niektórych genomiki i biometrii; ręczne rozpoznawanie wzorców wizualnych byłoby znacznie mniejsze w porównaniu z obecnymi uciążliwymi szkoleniami w zakresie radiologii.



