2-pirydon - 2-Pyridone
|
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
Pirydyn-2( 1H )-on |
|||
| Inne nazwy
2 (1 H ) -pirydynonu
2 (1 H ) -pirydon 1 H pirydyno-2-onu 2-pirydon 1,2-dihydro-2-oxopyridine 1 H -2-pirydon 2-Oxopyridone 2-pirydynolu 2-hydroksypirydyny |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CZEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA |
100.005.019 |
||
| Numer WE | |||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| Numer RTECS | |||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 5 H 5 N O | |||
| Masa cząsteczkowa | 95,101 g·mol -1 | ||
| Wygląd zewnętrzny | Bezbarwne krystaliczne ciało stałe | ||
| Gęstość | 1,39 g/cm³ | ||
| Temperatura topnienia | 107,8 ° C (226,0 ° F; 380,9 K) | ||
| Temperatura wrzenia | 280 °C (536 °F; 553 K) rozkład. | ||
| Rozpuszczalność w innych rozpuszczalnikach | Rozpuszczalny w wodzie , metanolu , acetonie |
||
| Kwasowość (p K a ) | 11,65 | ||
| UV-vis (λ max ) | 293 nm (ε 5900, roztwór H 2 O) | ||
| Struktura | |||
| rombowy | |||
| planarny | |||
| 4.26 D | |||
| Zagrożenia | |||
| Główne zagrożenia | irytujący | ||
| Arkusz danych dotyczących bezpieczeństwa | Zobacz: strona danych | ||
| Piktogramy GHS |
 
|
||
| Hasło ostrzegawcze GHS | Zagrożenie | ||
| H301 , H315 , H319 , H335 | |||
| P261 , P264 , P270 , P271 , P280 , P301 + 310 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |||
| NFPA 704 (ognisty diament) | |||
| Temperatura zapłonu | 210 ° C (410 ° F; 483 K) | ||
| Związki pokrewne | |||
|
Inne aniony
|
2-pirydynolan | ||
|
Inne kationy
|
Jon 2-hydroksypirydyniowy | ||
|
Powiązane grupy funkcyjne
|
alkohol , laktam , laktim , pirydyna , keton |
||
|
Związki pokrewne
|
pirydyna , tymina , cytozyna , uracyl , benzen |
||
| Strona z danymi uzupełniającymi | |||
|
Współczynnik załamania ( n ), stała dielektryczna (ε r ) itp. |
|||
|
Dane termodynamiczne |
Zachowanie fazowe ciało stałe-ciecz-gaz |
||
| UV , IR , NMR , MS | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
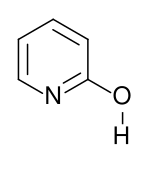
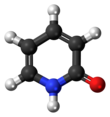
2-pirydon to związek organiczny o wzorze C
5h
4NH(O) . Jest to bezbarwne ciało stałe. Powszechnie wiadomo, że tworzy dimery z wiązaniami wodorowymi i jest to również klasyczny przypadek związku, który istnieje jako tautomery .
Tautomeria
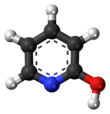
Drugim tautomerem jest 2-hydroksypirydyna. Ten tautomeria laktamowo- laktymowa może być również wykazywana w wielu pokrewnych związkach.
Tautomeria w stanie stałym
Grupa amidowa może brać udział w wiązaniu wodorowym z innymi indywiduami zawierającymi azot i tlen .
Dominującą postacią ciała stałego jest 2-pirydon. Zostało to potwierdzone przez krystalografię rentgenowską, która pokazuje, że wodór w stanie stałym jest bliżej azotu niż tlenu (ze względu na niską gęstość elektronową przy wodorze dokładne pozycjonowanie jest trudne), oraz spektroskopię IR , która pokazuje że występuje częstotliwość wzdłużna C=O, podczas gdy częstotliwości OH są nieobecne.
Tautomeria w rozwiązaniu
Ustalenie, która z dwóch form tautomerycznych występuje w roztworze , było przedmiotem wielu publikacji. Różnica energii wydaje się być bardzo małe i zależy od polaryzacji w rozpuszczalniku . Rozpuszczalniki niepolarne sprzyjają tworzeniu 2-hydroksypirydyny, podczas gdy rozpuszczalniki polarne, takie jak alkohole i woda, sprzyjają tworzeniu 2-pirydonu.
Różnica energii dla dwóch tautomerów w fazie gazowej została zmierzona metodą spektroskopii w podczerwieni i wyniosła 2,43 do 3,3 kJ / mol dla stanu stałego oraz 8,95 kJ/mol i 8,83 kJ/mol dla stanu ciekłego.
Mechanizm tautomeryzacji A
Pojedyncza tautomeryzacja molekularna ma zabroniony 1-3 suprafacial stan przejściowy, a zatem ma wysoką barierę energetyczną dla tej tautomeryzacji , która obliczono metodami teoretycznymi na 125 lub 210 kJ/mol. Bezpośrednia tautomeryzacja nie jest energetycznie faworyzowana. Istnieją inne możliwe mechanizmy tej tautomeryzacji.
Dimeryzacja
2-pirydon i 2-hydroksypirydyna mogą tworzyć dimery z dwoma wiązaniami wodorowymi.
Agregacja w stanie stałym
W stanie stałym forma dimeryczna nie występuje; 2-pirydony tworzą strukturę helikalną nad wiązaniami wodorowymi. Niektóre podstawione 2-pirydony tworzą dimer w stanie stałym, na przykład 5-metylo-3-karbonitryl-2-pirydon. Wyznaczenie wszystkich tych struktur wykonano metodą krystalografii rentgenowskiej . W stanie stałym wodór znajduje się bliżej tlenu, więc można by uznać za słuszne nazwanie bezbarwnych kryształów w kolbie 2-pirydonem.
Agregacja w roztworze
W roztworze obecna jest forma dimeryczna; stosunek dimeryzacji jest silnie zależny od polarności rozpuszczalnika. Rozpuszczalniki polarne i protyczne oddziałują z wiązaniami wodorowymi i powstaje więcej monomerów . Efekty hydrofobowe w rozpuszczalnikach niepolarnych prowadzą do przewagi dimeru. Stosunek form tautomerycznych zależy również od rozpuszczalnika. Wszystkie możliwe tautomery i dimery mogą być obecne i tworzyć równowagę, a dokładny pomiar wszystkich stałych równowagi w układzie jest niezwykle trudny.
( Spektroskopia NMR jest metodą powolną, spektroskopia IR o wysokiej rozdzielczości w rozpuszczalniku jest trudna, szeroka absorpcja w spektroskopii UV utrudnia rozróżnienie 3 i więcej bardzo podobnych cząsteczek ).
Niektóre publikacje skupiają się tylko na jednym z dwóch możliwych wzorców, a pomijają wpływ drugiego. Na przykład obliczenie różnicy energii dwóch tautomerów w roztworze niepolarnym doprowadzi do błędnego wyniku, jeśli duża ilość substancji znajduje się po stronie dimeru w równowadze.
Mechanizm tautomeryzacji B
Bezpośrednia tautomeryzacja nie jest faworyzowana energetycznie, ale dimeryzacja, po której następuje podwójny transfer protonów i dysocjacja dimeru, jest samokatalityczną ścieżką od jednego tautomeru do drugiego. Rozpuszczalniki protonowe również pośredniczą w przenoszeniu protonów podczas tautomeryzacji.
Synteza
2-Piron można otrzymać w reakcji cyklizacji i przekształcić w 2-pirydon w reakcji wymiany z amoniakiem :
Pirydyna tworzy N- tlenek z niektórymi środkami utleniającymi, takimi jak nadtlenek wodoru . Ten N- tlenek pirydyny ulega reakcji przegrupowania do 2-pirydonu w bezwodniku octowym :
W kondensacji Guareschi-Thorpe cyjanoacetamid reaguje z 1,3-diketonem do 2-pirydonu . Reakcja została nazwana na cześć Icilio Guareschi i Jocelyn Field Thorpe .
Właściwości chemiczne
Aktywność katalityczna
2-pirydon katalizuje różne reakcje zależne od protonów, na przykład aminolizę estrów. W niektórych przypadkach jako rozpuszczalnik stosuje się stopiony 2-pirydon. 2-pirydon ma duży wpływ na reakcję aktywowanych estrów z aminami w niepolarnym rozpuszczalniku , co przypisuje się jego tautomeryzacji i użyteczności jako receptora ditopowego. Aktualne zainteresowanie skupia się na przenoszeniu protonów z 2-pirydonu i jego tautomeru przy użyciu znakowania izotopowego , kinetyki i metod kwantowo-chemicznych w celu określenia etapu determinującego szybkość w mechanizmie reakcji.
Chemia koordynacyjna
2-pirydon i niektóre pochodne służą jako ligandy w chemii koordynacyjnej, zwykle jako ligand łączący 1,3, podobny do karboksylanu .
W naturze
2-pirydon nie występuje naturalnie, ale pochodna została wyizolowana jako kofaktor w niektórych hydrogenazach .
Zachowanie środowiskowe
2-pirydon jest szybko rozkładany przez mikroorganizmy w środowisku glebowym, z okresem półtrwania krótszym niż tydzień. Wielu badaczy wyizolowało organizmy zdolne do wzrostu na 2-pirydonie jako jedynym źródle węgla, azotu i energii. Najintensywniej przebadanym degradatorem 2-pirydonu jest Gram-dodatnia bakteria Arthrobacter crystallopoietes , członek gromady Actinobacteria, która obejmuje liczne pokrewne organizmy, które, jak wykazano, rozkładają pirydynę lub jedną lub więcej pirydyn podstawionych alkilem, karboksylem lub hydroksylem. Degradacja 2-pirydonu jest zwykle inicjowana przez atak monooksygenazy, w wyniku czego powstaje diol, taki jak 2,5-dihydroksypirydyna, który jest metabolizowany poprzez szlak maleaminianowy. Rozszczepienie pierścienia następuje poprzez działanie monooksygenazy 2,5-dihydroksypirydyny, która jest również zaangażowana w metabolizm kwasu nikotynowego poprzez szlak maleaminianowy. W przypadku Arthrobacter crystallopoietes przynajmniej część szlaku degradacji jest przenoszona przez plazmid. Diole pirydynowe ulegają przemianie chemicznej w roztworze, tworząc intensywnie zabarwione pigmenty. Podobne pigmenty zaobserwowano w degradacji chinoliny , również z powodu transformacji metabolitów, jednak żółte pigmenty często zgłaszane w degradacji wielu rozpuszczalników pirydynowych, takich jak niepodstawiona pirydyna lub pikolina , na ogół wynikają z nadprodukcji ryboflawiny w obecności tych rozpuszczalników. Mówiąc ogólnie, degradacja pirydonów, dihydroksypirydyn i kwasów pirydynokarboksylowych jest powszechnie mediowana przez oksygenazy, podczas gdy degradacja rozpuszczalników pirydynowych często nie zachodzi i może w niektórych przypadkach obejmować wstępny etap redukcyjny.
Zobacz też
- 2-pirydon (strona z danymi)
- 2-Pyrone
- 4-pirydon
- 5-metylo-2-pirydon jest używany do wytwarzania pirfenidonu .
Bibliografia
Ogólne odniesienia
-
Engdahl K.; Ahlberg P. (1977). Journal of Chemical Research : 340-341. Brakujące lub puste
|title=( pomoc ) - Bensaude O, Chevrier M, Dubois J (1978). „Laktim-laktam tautomeryczna równowaga 2-hydroksypirydyn. 1. Mechanizm wiązania kationów, dimeryzacji i interkonwersji w rozpuszczalnikach aprotonowych. Badanie spektroskopowe i kinetyczne ze skokiem temperatury”. J. Am. Chem. Soc. 100 (22): 7055–7066. doi : 10.1021/ja00490a046 .
- Bensaude O, Dreyfus G, Dodin G, Dubois J (1977). „Wewnątrzcząsteczkowy niedysocjacyjny transfer protonów w wodnych roztworach tautomerycznych heterocykli: badanie kinetyczne skoku temperatury”. J. Am. Chem. Soc. 99 (13): 4438–4446. doi : 10.1021/ja00455a037 .
- Bensaude O, Chevrier M, Dubois J (1978). „Wpływ nawodnienia na równowagę tautomeryczną”. Czworościan Lett. 19 (25): 2221-2224. doi : 10.1016/S0040-4039(01)86850-7 .
- Hammes GG, Park AC (1969). „Badania kinetyczne i termodynamiczne wiązania wodorowego”. J. Am. Chem. Soc. 91 (4): 956–961. doi : 10.1021/ja01032a028 .
- Hammes GG, Spivey HO (1966). „Badanie kinetyczne dimeryzacji wiązań wodorowych 2-pirydonu”. J. Am. Chem. Soc. 88 (8): 1621–1625. doi : 10.1021/ja00960a006 . PMID 5942979 .
- Dziób P, Covington JB, Smith SG (1976). „Badania strukturalne układów tautomerycznych: znaczenie stowarzyszenia dla 2-hydroksypirydyno-2-pirydonu i 2-merkaptopirydyno-2-tiopirydonu”. J. Am. Chem. Soc. 98 (25): 8284–8286. doi : 10.1021/ja00441a079 .
- Dziób P, Covington JB, Biały JM (1980). „Ilościowy model wpływu rozpuszczalnika na hydroksypirydyno-pirydon i równowaga merkaptopirydyno-tiopirydonu: korelacja z efektami pola reakcji i wiązania wodorowego”. J.Org. Chem. 45 (8): 1347–1353. doi : 10.1021/jo01296a001 .
- Dziób P, Covington JB, Smith SG, Biały JM, Zeigler JM (1980). „Przemieszczenie równowag protomerycznych przez samo-asocjację: hydroksypirydyno-pirydon i pary izomerów merkaptopirydyny-tiopirydon”. J.Org. Chem. 45 (8): 1354–1362. doi : 10.1021/jo01296a002 .