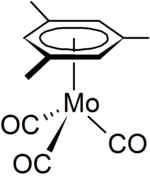Mezytylen - Mesitylene
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
1,3,5-trimetylobenzen |
|||
| Inne nazwy
Mezytylen
sym -Trimetylobenzen |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CZEBI | |||
| ChemSpider | |||
| Karta informacyjna ECHA |
100,003,278 |
||
| Numer WE | |||
| KEGG | |||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
| Numer ONZ | 2325 | ||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 9 H 12 | |||
| Masa cząsteczkowa | 120,19 g/mol | ||
| Wygląd zewnętrzny | Klarowna, bezbarwna ciecz | ||
| Zapach | Charakterystyczny, aromatyczny | ||
| Gęstość | 0,8637 g / cm 3 w temperaturze 20 ° C | ||
| Temperatura topnienia | -44,8 ° C (-48,6 ° F; 228,3 K) | ||
| Temperatura wrzenia | 164,7 ° C (328,5 ° F; 437,8 K) | ||
| 0,002% (20°C) | |||
| Ciśnienie pary | 2 mmHg (20°C) | ||
| -92,32·10 -6 cm 3 /mol | |||
| Struktura | |||
| 0,047 D | |||
| Zagrożenia | |||
| Arkusz danych dotyczących bezpieczeństwa | [1] | ||
| Temperatura zapłonu | 50°C; 122 ° F; 323 tys | ||
| NIOSH (limity ekspozycji dla zdrowia w USA): | |||
|
PEL (dopuszczalne)
|
Żaden | ||
|
REL (zalecane)
|
TWA 25 ppm (125 mg/m 3 ) | ||
|
IDLH (Bezpośrednie niebezpieczeństwo)
|
NS | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Mezytylen lub 1,3,5-trimetylobenzen jest pochodną benzenu z trzema podstawnikami metylowymi ułożonymi symetrycznie wokół pierścienia. Pozostałe dwa izomeryczne trimetylobenzeny to 1,2,4-trimetylobenzen (pseudocumen) i 1,2,3-trimetylobenzen (hemimelliten). Wszystkie trzy związki mają wzór C 6 H 3 (CH 3 ) 3 , który jest ogólnie znany pod nazwą C 6 H 3 Me 3 . Mezytylen to bezbarwna ciecz o słodkim aromatycznym zapachu. Jest składnikiem smoły węglowej , która jest jej tradycyjnym źródłem. Jest prekursorem różnorodnych chemikaliów wysokowartościowych . Mezytylu grupę (MES) oznacza podstawnik o wzorze C 6 H 2 Me 3 i znajduje się w różnych innych związków.
Przygotowanie
Mezytylen wytwarza się przez zrównoważenie ksylenu (lub jego proste alkilowanie metylem ) nad stałym katalizatorem kwasowym :
- 2 C 6 H 4 (CH 3 ) 2 ⇌ C 6 H 3 (CH 3 ) 3 + C 6 H 5 CH 3
- C 6 H 4 (CH 3 ) 2 + CH 3 OH → C 6 H 3 (CH 3 ) 3 + H 2 O
Trimeryzacji z acetonu przez kondensacji aldolowej , która jest katalizowana i odwodnionego przez kwasu siarkowego otrzymuje się mieszaniny 1,3,5- i 1,2,4-trimetylobenzenów.
Reakcje
Utlenianie mezytylen z kwasu azotowego , otrzymuje się kwas trimezynowy , C 6 H 3 (COOH), +3 . Za pomocą dwutlenku manganu , łagodniejszy środek utleniający , 3,5-dimetylo benzaldehydu powstaje. Mezytylen jest utleniany kwasem trifluoronadoctowym z wytworzeniem mesitolu (2,4,6-trimetylofenolu).
Aplikacje
Mezytylen jest stosowany głównie jako prekursor 2,4,6-trimetyloaniliny , prekursora barwników. Ta pochodna jest wytwarzana przez selektywne mononitrowanie mezytylenu, unikając utleniania grup metylowych.
Dodatek i składnik niektórych mieszanek avgas (benzyny lotniczej).
Zastosowania niszowe
Mezytylen jest używany w laboratorium jako specjalistyczny rozpuszczalnik. Może również działać jako ligand w chemii metaloorganicznej , czego przykładem jest kompleks organomolibdenu [( η 6 -C 6 H 3 Me 3 )Mo(CO) 3 ]. który można otrzymać z heksakarbonylu molibdenu .
W przemyśle elektronicznym mezytylen był używany jako wywoływacz dla silikonów fotowzorowalnych ze względu na jego właściwości rozpuszczalnikowe.
Trzy aromatyczne atomy wodoru mezytylenu znajdują się w identycznych środowiskach przesunięcia chemicznego. W związku z tym, że tylko daje pojedynczy pik w pobliżu 6,8 ppm w 1 H NMR widma; to samo odnosi się również do dziewięciu protonów metylowych , które dają singlet bliski 2,3 ppm. Z tego powodu mezytylen jest czasami używany jako wzorzec wewnętrzny w próbkach NMR, które zawierają aromatyczne protony.
Kwas uwitowy otrzymywany jest przez utlenienie mezytylenu lub kondensację kwasu pirogronowego z wodą barytową .
Reakcji Gattermann można uprościć przez zastąpienie HCN / AlCl 3 połączenie z cyjankiem cynku (Zn (CN) 2 ). Chociaż jest wysoce toksyczny, Zn(CN) 2 jest ciałem stałym, dzięki czemu praca z nim jest bezpieczniejsza niż gazowy cyjanowodór (HCN). Zn(CN) 2 reaguje z HCl tworząc kluczowy reagent HCN i Zn(CN) 2, który służy jako katalizator kwasu Lewisa in situ . Przykładem metody Zn(CN) 2 jest synteza mezytaldehydu z mezytylenu.
Historia
Mezytylen został po raz pierwszy przygotowany w 1837 roku przez Roberta Kane'a , irlandzkiego chemika, przez ogrzewanie acetonu ze stężonym kwasem siarkowym. Nazwał swoją nową substancję „mezytylenem”, ponieważ niemiecki chemik Carl Reichenbach nazwał aceton „mesytem” (od greckiego μεσίτης, mediator), a Kane wierzył, że jego reakcja spowodowała odwodnienie mezytu, przekształcając go w alken „mezytylen”. Jednak określenie przez Kane'a składu chemicznego („wzór empiryczny”) mezytylenu było błędne. Prawidłowy wzór empiryczny dostarczył August W. von Hofmann w 1849 roku. W 1866 Adolf von Baeyer wykazał, że struktura mezytylenu była zgodna ze strukturą 1,3,5-trimetylobenzenu; jednak rozstrzygający dowód, że mezytylen był identyczny z 1,3,5-trimetylobenzenem, dostarczył Albert Ladenburg w 1874 roku.
Grupa mezytylowa
Grupa (CH 3 ) 3 C 6 H 2 - nazywana jest mezytylem (symbol grupy organicznej: Mes). Pochodne mezytylu np tetramesityldiiron , są zazwyczaj wytwarzane z odczynnikiem Grignarda (CH 3 ) 3 C 6 H 2 MgBr. Ze względu na duże zapotrzebowanie przestrzenne, grupa mezytylowa jest wykorzystywana jako duża grupa blokująca w katalizie asymetrycznej (w celu zwiększenia diastereo- lub enancjoselektywności) i chemii metaloorganicznej (w celu stabilizacji niskiego stopnia utlenienia lub centrów metali o niskiej liczbie koordynacyjnej). Większe analogi o jeszcze większym zapotrzebowaniu przestrzennym, na przykład 2,6-diizopropylofenyl (Dipp) i analogicznie nazwane Tripp (( i Pr) 3 C 6 H 2 , Is) i supermezytyl (( t Bu) 3 C 6 H 2 , Mes *) grupy, mogą być jeszcze skuteczniejsze w osiąganiu tych celów.
Bezpieczeństwo i środowisko
Mezytylen jest również głównym miejskim lotnym związkiem organicznym (LZO), który powstaje w wyniku spalania . Odgrywa znaczącą rolę w tworzeniu aerozolu i ozonu troposferycznego oraz innych reakcjach w chemii atmosfery .
Bibliografia
- ^ B Nomenclature of Organie Chemistry: zaleceń i preferowana IUPAC 2013 Names (Blue Book) . Cambridge: Królewskie Towarzystwo Chemiczne . 2014. s. 139. doi : 10.1039/9781849733069-FP001 . Numer ISBN 978-0-85404-182-4.
- ^ a b c d e f g h Kieszonkowy przewodnik po zagrożeniach chemicznych NIOSH. „#0639” . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- ^ Zhao, czerwiec; Zhang, Renyi (2004). „Stałe szybkości reakcji przeniesienia protonu między jonem hydroniowym (H 3 O + ) a lotnymi związkami organicznymi”. Środowisko atmosferyczne . 38 (14): 2177–2185. Kod Bib : 2004AtmEn..38.2177Z . doi : 10.1016/j.atmosenv.2004.01.019 .
- ^ B Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz Gerd Collin, Dieter Mayer, Hartmut HOKE „węglowodorów” w Ullmann Encyklopedii Chemii Przemysłowej 2002 Wiley-VCH, Weinheim. doi : 10.1002/14356007.a13_227 .
- ^ Cumming, WM (1937). Chemia organiczna systematyczna (3E) . Nowy Jork, USA: D. Van Nostrand Company. P. 57.
- ^ Komory, Richard D. (2004). „Funkcjonalne związki zawierające tlen, siarkę lub azot i ich pochodne” . Fluor w chemii organicznej . CRC Naciśnij . s. 242-243. Numer ISBN 9780849317903.
- ^ Gerald Booth (2007). „Związki nitro, aromatyczne”. Encyklopedia Chemii Przemysłowej Ullmanna . Weinheim: Wiley-VCH. doi : 10.1002/14356007.a17_411 . Numer ISBN 978-3527306732.
- ^ Girolami, GS; Rauchfuss, TB i Angelici, RJ, Synteza i technika w chemii nieorganicznej , University Science Books: Mill Valley, CA, 1999. ISBN 0-93570248-2 .
- ^ „Mezytylen (1,3,5-trimetylobenzen)” .
- ^ „Definicja kwasu uwitowego” . merriam-webster.com . Źródło 31 października 2016 .
- ^ Adams R .; Levine, I. (1923). „Uproszczenie syntezy Gattermann hydroksyaldehydów”. J. Am. Chem. Soc. 45 (10): 2373–77. doi : 10.1021/ja01663a020 .
- ^ Adams Roger (1957). Reakcje organiczne, tom 9 . Nowy Jork: John Wiley & Sons, Inc. str. 38 i 53-54. doi : 10.1002/0471264180.lub009.02 . Numer ISBN 9780471007265.
- ^ Fuson, RC; Horning, WE; Rowland, SP; Oddział, ML (1955). „Mezytaldehyd”. Syntezy organiczne . doi : 10.15227/orgsyn.023.0057 .; Tom zbiorowy , 3 , s. 549
- ^ Robert Kane (1839) "Na serii kombinacji pochodzących od spirytusu pirooctowego [acetonu]" Transakcje Królewskiej Akademii Irlandzkiej , tom. 18, strony 99–125.
- ^ Badania Reichenbacha zaczerpnięto z: C. Reichenbach (1834) „Ueber Mesit (Essiggeist) und Holzgeist” (O mesit (spirytusie octu) i spirytusach drzewnych), Annalen der Pharmacie , tom. 10, nie. 3, strony 298–314.
- ^ Dla wyjaśnienia oryginału nazwy „mezytylen”, patrz także: Henry E. Roscoe, A Treatise on Chemistry (New York, New York: D. Appleton and Co., 1889), tom. III, s. 102 , przypis 2.
- ^ AW Hofmann (1849) „O składzie mezytylolu [mezitylenu] i niektórych jego pochodnych”, The Quarterly Journal of the Chemical Society of London , tom. 2, strony 104–115 . (Uwaga: empiryczna formuła mezytylenu podana w pracy Hofmanna ( C 18 H 12 ) jest niepoprawna; jednak stało się tak, ponieważ Hofmann użył 6 jako masy atomowej węgla, zamiast prawidłowej masy atomowej 12. waga jest używana w obliczeniach Hofmanna, jego wyniki dają poprawny wzór empiryczny C 9 H 12 .)
- ^ Adolf von Baeyer (1866) „Ueber die Condensationsproducte des Acetons” (O produktach kondensacji acetonu), Annalen der Chemie und Pharmacie , tom. 140, s. 297–306.
- ^ Albert Ladenburg (1874) "Ueber das Mesitylen" (O mezytylenie), Berichte der deutschen chemischen Gesellschaft , tom. 7, strony 1133–1137. doi : 10.1002/cber.18740070261