Spalanie - Combustion

Spalanie lub spalanie to egzotermiczna reakcja chemiczna redoks w wysokiej temperaturze pomiędzy paliwem (reduktorem) a utleniaczem , zwykle tlenem atmosferycznym , która wytwarza utlenione, często gazowe produkty w mieszaninie zwanej dymem . Spalanie nie zawsze prowadzi do pożaru , ponieważ płomień jest widoczny tylko wtedy, gdy substancje podlegające spalaniu odparowują, ale gdy tak się dzieje, płomień jest charakterystycznym wskaźnikiem reakcji. Podczas gdy energia aktywacji musi zostać pokonana, aby zainicjować spalanie (np. użycie zapalonej zapałki do rozpalenia ognia), ciepło płomienia może zapewnić wystarczającą ilość energii, aby reakcja była samowystarczalna. Spalanie to często skomplikowana sekwencja elementarnych reakcji rodnikowych . Paliwa stałe , takie jak drewno i węgiel , najpierw podlegają endotermicznej pirolizie w celu wytworzenia paliw gazowych, których spalanie dostarcza następnie ciepła potrzebnego do wytworzenia większej ich ilości. Spalanie jest często na tyle gorące, że powstaje światło żarowe w postaci żarzenia lub płomienia . A Przykład prosty widać na spalaniu wodoru i tlenu w wodzie pary , to reakcja zwykle stosowane do paliwa silników rakietowych . Ta reakcja uwalnia 242 kJ / mol ciepła i odpowiednio obniża entalpię (przy stałej temperaturze i ciśnieniu):
Spalanie paliwa organicznego w powietrzu jest zawsze egzotermiczne, ponieważ wiązanie podwójne w O 2 jest znacznie słabsze niż inne wiązania podwójne lub pary wiązań pojedynczych, a zatem powstawanie silniejszych wiązań w produktach spalania CO
2i H
2O powoduje uwolnienie energii. Energie wiązania w paliwie odgrywają tylko niewielką rolę, ponieważ są podobne do energii w produktach spalania; np. suma energii wiązania CH 4 jest prawie taka sama jak energia CO
2. Ciepło spalania wynosi około -418 kJ na mol O 2 zużytego w reakcji spalania i może być określona na podstawie składu pierwiastkowego paliwa.
Spalanie niekatalizowane w powietrzu wymaga stosunkowo wysokich temperatur. Całkowite spalanie jest stechiometryczne w odniesieniu do paliwa, gdzie nie ma pozostałego paliwa, a najlepiej, nie ma resztkowego utleniacza. Termodynamicznie równowaga chemiczna spalania w powietrzu jest w przeważającej mierze po stronie produktów. Jednak całkowite spalanie jest prawie niemożliwe do osiągnięcia, ponieważ równowaga chemiczna niekoniecznie jest osiągnięta, lub może zawierać niespalone produkty, takie jak tlenek węgla , wodór, a nawet węgiel ( sadza lub popiół). Tak więc wytwarzany dym jest zwykle toksyczny i zawiera niespalone lub częściowo utlenione produkty. Jakiekolwiek spalanie w wysokich temperaturach w powietrzu atmosferycznym , które zawiera 78 procent azotu , spowoduje również wytworzenie niewielkich ilości kilku tlenków azotu , potocznie zwanych NOx , ponieważ spalanie azotu jest termodynamicznie faworyzowane w wysokich, ale nie niskich temperaturach. Ponieważ spalanie rzadko jest czyste, czyszczenie gazu opałowego lub katalizatory mogą być wymagane przez prawo.
Pożary występują naturalnie, w wyniku uderzeń piorunów lub produktów wulkanicznych . Spalanie ( pożar ) było pierwszą kontrolowaną reakcją chemiczną odkrytą przez człowieka w formie ognisk i ognisk i nadal jest główną metodą wytwarzania energii dla ludzkości. Zwykle paliwem jest węgiel , węglowodory lub bardziej skomplikowane mieszanki, takie jak drewno, które zawiera częściowo utlenione węglowodory. Energia cieplna wytwarzana ze spalania paliw kopalnych, takich jak węgiel lub olej , lub z paliw odnawialnych, takich jak drewno opałowe , jest pozyskiwana do różnych zastosowań, takich jak gotowanie , produkcja energii elektrycznej lub ogrzewanie przemysłowe lub domowe. Spalanie jest również obecnie jedyną reakcją wykorzystywaną do napędzania rakiet . Spalanie jest również wykorzystywane do niszczenia ( spalania ) odpadów, zarówno bezpiecznych, jak i niebezpiecznych.
Utleniacze do spalania mają wysoki potencjał utleniania i obejmują tlen atmosferyczny lub czysty , chlor , fluor , trifluorek chloru , podtlenek azotu i kwas azotowy . Na przykład wodór spala się w chlorze, tworząc chlorowodór z wydzielaniem ciepła i światła charakterystycznego dla spalania. Chociaż zwykle nie jest katalizowany, spalanie może być katalizowane przez platynę lub wanad , jak w procesie kontaktowym .
Rodzaje
Kompletny i niekompletny
Kompletny
W całkowitym spalaniu reagent spala się w tlenie i wytwarza ograniczoną liczbę produktów. Gdy węglowodór spala się w tlenie, w wyniku reakcji powstaje przede wszystkim dwutlenek węgla i woda. Podczas spalania pierwiastków produktami są przede wszystkim najpowszechniejsze tlenki. Węgiel da dwutlenek węgla , siarka dwutlenek siarki , a żelazo tlenek żelaza(III) . Azot nie jest uważany za substancję palną gdy tlen jest utleniaczem . Wciąż niewielkie ilości różnych tlenków azotu (powszechnie oznaczanych NO
x gatunków) tworzą się, gdy powietrze jest utleniaczem.
Spalanie niekoniecznie jest korzystne dla maksymalnego stopnia utlenienia i może zależeć od temperatury. Na przykład trójtlenek siarki nie jest wytwarzany ilościowo przez spalanie siarki. NIE
x gatunki pojawiają się w znacznych ilościach powyżej około 2800 ° F (1540 ° C), a więcej jest produkowany w wyższych temperaturach. Ilość NO
x jest również funkcją nadmiaru tlenu.
W większości zastosowań przemysłowych i pożarów , powietrze jest źródło tlenu ( O
2). W powietrzu każdy mol tlenu miesza się z około3,71 mola azotu. Azot nie bierze udziału w spalaniu, ale w wysokich temperaturach część azotu zostanie przekształcona w NO
x(głównie NO , przy znacznie mniejszych ilościach NO
2). Z drugiej strony, gdy nie ma wystarczającej ilości tlenu do całkowitego spalenia paliwa, część węgla w paliwie jest przekształcana w tlenek węgla , a część wodorów pozostaje nieprzereagowana. Kompletny zestaw równań dotyczących spalania węglowodoru w powietrzu wymaga zatem dodatkowego obliczenia rozkładu tlenu między węglem a wodorem w paliwie.
Ilość powietrza wymagana do całkowitego spalania jest znana jako czyste powietrze. Jednak w praktyce stosowane powietrze jest 2-3 razy większe niż czyste powietrze.
Niekompletny
Niepełne spalanie nastąpi, gdy nie będzie wystarczającej ilości tlenu, aby paliwo przereagowało całkowicie w celu wytworzenia dwutlenku węgla i wody. Dzieje się tak również wtedy, gdy spalanie jest gaszone przez radiator, taki jak twarda powierzchnia lub pułapka płomienia. Podobnie jak w przypadku całkowitego spalania, woda jest wytwarzana przez niepełne spalanie; jednak węgiel , tlenek węgla i wodorotlenek są wytwarzane zamiast dwutlenku węgla.
W przypadku większości paliw, takich jak olej napędowy, węgiel lub drewno, piroliza zachodzi przed spalaniem. W niepełnym spalaniu produkty pirolizy pozostają niespalone i zanieczyszczają dym szkodliwymi cząstkami stałymi i gazami. Problemem są również związki częściowo utlenione; częściowe utlenianie etanolu może wytwarzać szkodliwy aldehyd octowy , a węgiel może wytwarzać toksyczny tlenek węgla.
Konstrukcje urządzeń spalinowych mogą poprawiać jakość spalania, takich jak palniki i silniki spalinowe . Dalsze ulepszenia można osiągnąć za pomocą urządzeń do dopalania katalitycznego (takich jak konwertery katalityczne ) lub przez prosty częściowy powrót spalin do procesu spalania. Takie urządzenia są wymagane przez przepisy dotyczące ochrony środowiska w samochodach w większości krajów. Mogą być one niezbędne do osiągnięcia przez duże urządzenia spalania, takie jak elektrociepłownie , norm emisyjnych .
Stopień spalania można zmierzyć i przeanalizować za pomocą sprzętu testowego. Wykonawcy HVAC , strażacy i inżynierowie używają analizatorów spalania do testowania wydajności palnika podczas procesu spalania. W ten sposób można również zmierzyć sprawność silnika spalinowego, a niektóre stany USA i lokalne gminy wykorzystują analizę spalania do określenia i oceny sprawności pojazdów na drogach.
Niepełne spalanie wytwarza tlenek węgla
Jednym z produktów niepełnego spalania jest tlenek węgla . Węgiel jest uwalniany w normalnej reakcji niecałkowitego spalania, tworząc sadzę i pył. Ponieważ tlenek węgla jest gazem trującym, preferowane jest całkowite spalanie, ponieważ podczas oddychania tlenek węgla może również powodować problemy z oddychaniem, ponieważ zastępuje tlen i łączy się z hemoglobiną.
Problemy związane z niepełnym spalaniem
- Problemy środowiskowe:
Tlenki te łączą się z wodą i tlenem w atmosferze, tworząc kwas azotowy i kwas siarkowy , które powracają na powierzchnię Ziemi w postaci kwaśnego osadu lub „kwaśnego deszczu”. Kwasowe osadzanie szkodzi organizmom wodnym i zabija drzewa. Ze względu na tworzenie pewnych składników odżywczych, które są mniej dostępne dla roślin, takich jak wapń i fosfor, zmniejsza produktywność ekosystemu i gospodarstw. Dodatkowym problemem związanym z tlenkami azotu jest to, że wraz z zanieczyszczeniami węglowodorowymi przyczyniają się do powstawania ozonu w warstwie przyziemnej , głównego składnika smogu.
- Problemy ze zdrowiem człowieka:
Wdychanie tlenku węgla powoduje bóle głowy, zawroty głowy, wymioty i nudności. Jeśli poziom tlenku węgla jest wystarczająco wysoki, ludzie tracą przytomność lub umierają. Długotrwałe narażenie na umiarkowane i wysokie poziomy tlenku węgla jest pozytywnie skorelowane z ryzykiem chorób serca. Ludzie, którzy przeżyli ciężkie zatrucie tlenkiem węgla, mogą cierpieć na długotrwałe problemy zdrowotne. Tlenek węgla z powietrza jest absorbowany w płucach, a następnie wiąże się z hemoglobiną w czerwonych krwinkach człowieka. Zmniejszyłoby to zdolność czerwonych krwinek do przenoszenia tlenu w całym ciele.
Tlący
Tlenie to powolna, niskotemperaturowa, bezpłomieniowa forma spalania, podtrzymywana przez ciepło wydzielane, gdy tlen bezpośrednio atakuje powierzchnię skondensowanego paliwa. Jest to typowo niepełna reakcja spalania. Materiały stałe, które mogą wytrzymać reakcję tlenia obejmują węgiel, celulozę , drewno , bawełnę , tytoń , torf , duff , humus , pianki syntetyczne, polimery zwęglające się (w tym pianka poliuretanowa ) i pył . Typowymi przykładami zjawisk tlących się są wywoływanie pożarów mieszkalnych na meblach tapicerowanych przez słabe źródła ciepła (np. papieros, zwarty przewód) oraz uporczywe spalanie biomasy za płonącymi frontami pożarów .
Szybki
Szybkie spalanie to forma spalania, inaczej zwana ogniem , w której uwalniane są duże ilości energii cieplnej i świetlnej , co często prowadzi do powstania płomienia . Jest to wykorzystywane w postaci maszyn, takich jak silniki spalinowe oraz w broni termobarycznej . Takie spalanie jest często nazywane szybkim spalaniem, choć dla silnika spalinowego jest to niedokładne. Silnik spalinowy pracuje nominalnie na kontrolowanym, szybkim spalaniu. Wybuch mieszanki paliwowo-powietrznej w silniku spalinowym nazywa się detonacją .
Spontaniczny
Spontaniczne spalanie jest rodzajem spalania, które następuje przez samonagrzewanie (wzrost temperatury w wyniku egzotermicznych reakcji wewnętrznych), następnie niekontrolowany przebieg termiczny (samo nagrzewanie, które szybko przyspiesza do wysokich temperatur) i wreszcie zapłon. Na przykład fosfor ulega samozapłonowi w temperaturze pokojowej bez zastosowania ciepła. Materiały organiczne poddawane kompostowaniu bakteryjnemu mogą generować wystarczającą ilość ciepła, aby osiągnąć punkt spalania.
Burzliwy
Spalanie powodujące turbulentny płomień jest najczęściej wykorzystywane w zastosowaniach przemysłowych (np. w turbinach gazowych , silnikach benzynowych itp.), ponieważ turbulencje wspomagają proces mieszania między paliwem a utleniaczem .
Mikrograwitacja
Termin „mikro” grawitacji odnosi się do stanu grawitacyjnego, który jest „niski” (tj. „mikro” w znaczeniu „mały” i niekoniecznie jednej milionowej normalnej grawitacji Ziemi), tak że wpływ wyporu na procesy fizyczne może być uważany za mały w porównaniu z innymi procesami przepływu, które byłyby obecne przy normalnej grawitacji. W takim środowisku dynamika transportu ciepła i przepływu może zachowywać się zupełnie inaczej niż w normalnych warunkach grawitacyjnych (np. płomień świecy przyjmuje kształt kuli). Badania spalania w mikrograwitacji przyczyniają się do zrozumienia szerokiej gamy aspektów, które są istotne zarówno dla środowiska statku kosmicznego (np. dynamika pożaru istotna dla bezpieczeństwa załogi na Międzynarodowej Stacji Kosmicznej ), jak i warunków naziemnych (na Ziemi) (np. dynamika spalania wspomagająca opracowywanie nowych mieszanek paliwowych poprawiających spalanie, procesy wytwarzania materiałów , zarządzanie temperaturą układów elektronicznych , dynamika wrzenia wielofazowego w przepływie i wiele innych).
Mikrospalanie
Procesy spalania, które zachodzą w bardzo małych ilościach, są uważane za mikrospalanie . Wysoki stosunek powierzchni do objętości zwiększa jednostkowe straty ciepła. Odległość gaszenia odgrywa istotną rolę w stabilizacji płomienia w takich komorach spalania .
Równania chemiczne
Stechiometryczne spalanie węglowodoru w tlenie
Ogólnie rzecz biorąc, równanie chemiczne dla stechiometrycznego spalania węglowodoru w tlenie to:
gdzie .
Na przykład spalanie stechiometryczne propanu w tlenie to:
Stechiometryczne spalanie węglowodoru w powietrzu
Jeśli spalanie stechiometryczne odbywa się przy użyciu powietrza jako źródła tlenu, azot obecny w powietrzu ( Atmosfera Ziemi ) można dodać do równania (chociaż nie reaguje), aby pokazać skład stechiometryczny paliwa w powietrzu i skład powstałego spalin. Należy zauważyć, że traktowanie wszystkich składników powietrza nie będących tlenem jako azotu daje stosunek „azotu” do tlenu wynoszący 3,77, tj. (100% - O2%) / O2%, gdzie O2% wynosi 20,95% obj.:
gdzie .
Na przykład spalanie stechiometryczne propanu ( ) w powietrzu wynosi:
Skład stechiometryczny propanu w powietrzu wynosi 1 / (1 + 5 + 18,87) = 4,02% obj.
Reakcja spalania stechiometrycznego dla C α H β O γ w powietrzu:
Reakcja spalania stechiometrycznego dla C α H β O γ S δ :
Reakcja spalania stechiometrycznego dla C α H β O γ N δ S ε :
Reakcja spalania stechiometrycznego dla C α H β O γ F δ :
Śladowe produkty spalania
Różne inne substancje zaczynają pojawiać się w znacznych ilościach w produktach spalania, gdy temperatura płomienia jest powyżej około1600 K . W przypadku stosowania nadmiaru powietrza azot może utleniać się do NO i w znacznie mniejszym stopniu do NO
2. CO tworzy przez dysproporcjonowanie z CO
2, i H
2i forma OH przez dysproporcjonowanie H
2O .
Na przykład, kiedy Spala się 1 mol propanu28,6 mola powietrza (120% ilości stechiometrycznej), produkty spalania zawierają 3,3% O
2. Na1400 K , równowagowe produkty spalania zawierają 0,03% NO i 0,002% OH . Na1800 K , produkty spalania zawierają 0,17% NO , 0,05% OH , 0,01% CO i 0,004% H
2.
Silniki Diesla pracują z nadmiarem tlenu, aby spalać małe cząstki, które mają tendencję do tworzenia się tylko przy stechiometrycznej ilości tlenu, co z konieczności powoduje emisję tlenku azotu . Zarówno Stany Zjednoczone, jak i Unia Europejska narzucają limity emisji tlenków azotu z pojazdów, co wymusza stosowanie specjalnych katalizatorów lub uzdatnianie spalin mocznikiem (patrz Płyn do silników Diesla ).
Niecałkowite spalanie węglowodoru w tlenie
Niecałkowite (częściowe) spalanie węglowodoru z tlenem daje mieszankę gazową zawierającą głównie CO
2, CO , H
2O i H
2. Takie mieszaniny gazów są powszechnie przygotowywane do stosowania jako atmosfery ochronne do obróbki cieplnej metali i do nawęglania gazowego . Ogólne równanie reakcji na niecałkowite spalanie jednego mola węglowodoru w tlenie to:
Gdy z spada poniżej około 50% wartości stechiometrycznej, CH
4może stać się ważnym produktem spalania; gdy z spada poniżej około 35% wartości stechiometrycznej, węgiel pierwiastkowy może stać się stabilny.
Produkty niecałkowitego spalania można obliczyć za pomocą bilansu materiałowego wraz z założeniem, że produkty spalania osiągnęły równowagę . Na przykład w spalaniu jednego mola propanu ( C
3h
8) z czterema molami O
2, powstaje siedem moli spalin, a z wynosi 80% wartości stechiometrycznej. Trzy równania równowagi elementarnej to:
- Węgiel:
- Wodór:
- Tlen:
Te trzy równania same w sobie są niewystarczające do obliczenia składu spalin. Jednak w pozycji równowagi reakcja konwersji gazu wodnego daje inne równanie:
- ;
Na przykład w 1200 K wartość K eq wynosi 0,728. Rozwiązując, spaliny składają się z 42,4% H
2O , 29,0% CO
2, 14,7% H
2i 13,9% CO . Węgiel staje się fazą stabilną w1200 K iciśnienie 1 atm, gdy z jest mniejsze niż 30% wartości stechiometrycznej, w którym to momencie produkty spalania zawierają więcej niż 98% H
2i CO oraz około 0,5% CH
4.
Substancje lub materiały, które ulegają spalaniu nazywamy paliwami . Najczęstsze przykłady to gaz ziemny, propan, nafta, olej napędowy, benzyna, węgiel drzewny, węgiel, drewno itp.
Paliwa płynne
Spalanie paliwa ciekłego w atmosferze utleniającej faktycznie zachodzi w fazie gazowej. Spala się para, a nie ciecz. Dlatego ciecz zwykle zapala się tylko powyżej pewnej temperatury: jej temperatura zapłonu . Temperatura zapłonu ciekłego paliwa to najniższa temperatura, w której może tworzyć zapalną mieszankę z powietrzem. Jest to minimalna temperatura, przy której w powietrzu znajduje się wystarczająca ilość odparowanego paliwa, aby rozpocząć spalanie.
Paliwa gazowe
Spalanie paliw gazowych może nastąpić przez jeden z czterech charakterystycznych typów spalania: dyfuzja palność , wstępnie miesza się płomienia , autoignitive przednich reakcji lub jako detonacji . Rodzaj spalania, które faktycznie występuje, zależy od stopnia, w jakim paliwo i utleniacz są mieszane przed ogrzewaniem: na przykład płomień dyfuzyjny powstaje, gdy paliwo i utleniacz są początkowo rozdzielone, podczas gdy wstępnie mieszany płomień powstaje w przeciwnym razie. Podobnie rodzaj spalania zależy również od ciśnienia: na przykład detonacja jest frontem reakcji samozapłonu w połączeniu z silną falą uderzeniową, nadającą jej charakterystyczny szczyt wysokiego ciśnienia i dużą prędkość detonacji .
Paliwa stałe
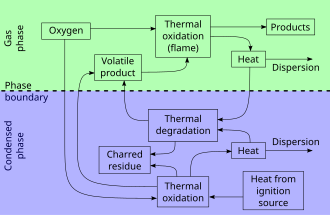
Proces spalania składa się z trzech stosunkowo odrębnych, ale zachodzących na siebie faz:
- Faza podgrzewania , kiedy niespalone paliwo jest podgrzewane do temperatury zapłonu, a następnie do temperatury zapłonu . W procesie podobnym do suchej destylacji zaczynają wydzielać się łatwopalne gazy .
- Faza destylacji lub faza gazowa , gdy mieszanina wydzielających się gazów palnych z tlenem zostaje zapalona. Energia produkowana jest w postaci ciepła i światła. Płomienie są często widoczne. Przenoszenie ciepła ze spalania do ciała stałego utrzymuje wydzielanie palnych oparów.
- Faza węgla drzewnego lub faza stała , gdy wydzielanie się gazów palnych z materiału jest zbyt niskie, aby trwała obecność płomienia, a zwęglone paliwo nie pali się szybko i tylko żarzy, a później tylko się tli .
Zarządzanie spalaniem
Wydajne ogrzewanie procesowe wymaga odzyskania jak największej części ciepła spalania paliwa do przetwarzanego materiału. Istnieje wiele dróg strat w działaniu procesu ogrzewania. Zazwyczaj dominująca straty ciepła jawnego wychodzenia z gazu odlotowego (tj spalin ). Temperatura i ilość gazu odlotowego wskazuje na jego zawartość cieplną ( entalpię ), dzięki czemu utrzymywanie jego niskiej ilości minimalizuje straty ciepła.
W idealnym piecu przepływ powietrza do spalania byłby dopasowany do przepływu paliwa, aby zapewnić każdej cząsteczce paliwa dokładną ilość tlenu potrzebną do spowodowania całkowitego spalania. Jednak w realnym świecie spalanie nie przebiega idealnie. Niespalone paliwo (zwykle CO i H
2) odprowadzane z systemu stanowi utratę wartości opałowej (jak również zagrożenie bezpieczeństwa). Ponieważ materiały palne są niepożądane w gazach odlotowych, podczas gdy obecność nieprzereagowanego tlenu stwarza minimalne obawy dotyczące bezpieczeństwa i ochrony środowiska, pierwszą zasadą zarządzania spalaniem jest dostarczanie większej ilości tlenu, niż jest to teoretycznie potrzebne, aby zapewnić spalanie całego paliwa. Dla metanu ( CH
4) spalanie wymaga na przykład nieco więcej niż dwóch cząsteczek tlenu.
Drugą zasadą zarządzania spalaniem jest jednak niestosowanie zbyt dużej ilości tlenu. Prawidłowa ilość tlenu wymaga trzech rodzajów pomiaru: po pierwsze, aktywnej kontroli przepływu powietrza i paliwa; po drugie, pomiar tlenu w gazach odlotowych; i po trzecie, pomiar gazów odlotowych. Dla każdego procesu ogrzewania istnieje optymalny warunek minimalnej utraty ciepła gazów odlotowych przy akceptowalnym poziomie stężenia substancji palnych. Minimalizacja nadmiaru tlenu przynosi dodatkową korzyść: dla danej temperatury gazu odlotowego poziom NOx jest najniższy, gdy nadmiar tlenu jest utrzymywany na najniższym poziomie.
Przestrzeganie tych dwóch zasad jest wspierane przez dokonywanie bilansów materiałowych i cieplnych w procesie spalania. Bilans materiałowy bezpośrednio wiąże stosunek powietrze / paliwo do procentu O
2w spalinach. Bilans cieplny odnosi ciepło dostępne do wsadu do całkowitego ciepła netto wytworzonego przez spalanie paliwa. Dodatkowe bilanse materiałowe i cieplne można sporządzić w celu ilościowego określenia korzyści termicznych wynikających z wstępnego podgrzewania powietrza do spalania lub wzbogacania go w tlen.
Mechanizm reakcji
Spalanie w tlenie jest reakcją łańcuchową, w której uczestniczy wiele różnych rodników pośrednich. Wysoka energia wymagana do inicjacji tłumaczy się niezwykłą strukturą cząsteczki ditlenowej . Najniższa energia konfiguracji cząsteczki ditlenowej jest stabilnym, stosunkowo niereaktywnym dwurodnikiem w stanie spinu tripletowego . Wiązanie można opisać za pomocą trzech wiążących par elektronów i dwóch antywiążących elektronów, z wyrównanymi spinami , tak że cząsteczka ma niezerowy całkowity moment pędu. Z drugiej strony większość paliw jest w stanie singletowym, z sparowanymi spinami i zerowym całkowitym momentem pędu. Interakcja między nimi jest mechanicznie kwantowo „ zabronionym przejściem ”, tj. możliwa z bardzo małym prawdopodobieństwem. Aby zainicjować spalanie, potrzebna jest energia, aby zmusić tlen do stanu sprzężonego spinu lub tlenu singletowego . Ten półprodukt jest niezwykle reaktywny. Energia dostarczana jest w postaci ciepła , a reakcja następnie wytwarza dodatkowe ciepło, co pozwala na jej kontynuację.
Uważa się, że spalanie węglowodorów jest inicjowane przez abstrakcję atomów wodoru (nie protonów) z paliwa do tlenu, dając rodnik wodoronadtlenkowy (HOO). Reaguje dalej dając wodoronadtlenki, które rozpadają się dając rodniki hydroksylowe . Istnieje ogromna różnorodność tych procesów, które wytwarzają rodniki paliwowe i rodniki utleniające. Rodzaje utleniające obejmują tlen singletowy, hydroksyl, tlen jednoatomowy i hydroperoksyl . Takie półprodukty są krótkotrwałe i nie można ich wyizolować. Jednak półprodukty nierodnikowe są stabilne i powstają przy niecałkowitym spalaniu. Przykładem jest aldehyd octowy wytwarzany podczas spalania etanolu . Półprodukt w spalaniu węgla i węglowodorów, tlenek węgla , ma szczególne znaczenie, ponieważ jest gazem trującym , ale także użytecznym ekonomicznie do produkcji gazu syntezowego .
Paliwa stałe i ciężkie płynne również podlegają wielu reakcjom pirolizy , które dają łatwiej utleniające się paliwa gazowe. Reakcje te są endotermiczne i wymagają stałego wkładu energii z trwających reakcji spalania. Brak tlenu lub inne niewłaściwie zaprojektowane warunki powodują, że te szkodliwe i rakotwórcze produkty pirolizy są emitowane jako gęsty, czarny dym.
Szybkość spalania to ilość materiału, który ulega spalaniu w określonym czasie. Może być wyrażona w gramach na sekundę (g/s) lub kilogramach na sekundę (kg/s).
Szczegółowe opisy procesów spalania, z punktu widzenia kinetyki chemicznej, wymagają sformułowania dużych i skomplikowanych sieci reakcji elementarnych. Na przykład spalanie paliw węglowodorowych zazwyczaj obejmuje setki związków chemicznych reagujących zgodnie z tysiącami reakcji.
Włączenie takich mechanizmów do obliczeniowych solwerów przepływów nadal stanowi dość trudne zadanie, głównie w dwóch aspektach. Po pierwsze, liczba stopni swobody (proporcjonalna do liczby związków chemicznych) może być dramatycznie duża; po drugie, termin źródłowy spowodowany reakcjami wprowadza odmienną liczbę skal czasowych, co powoduje sztywność całego układu dynamicznego . W rezultacie bezpośrednia symulacja numeryczna turbulentnych przepływów reaktywnych z paliwami ciężkimi szybko staje się niewykonalna nawet dla nowoczesnych superkomputerów.
W związku z tym opracowano mnóstwo metodologii zmniejszania złożoności mechanizmów spalania bez uciekania się do wysokiego poziomu szczegółowości. Przykłady dostarczają:
- Metoda Redystrybucji Relaksacyjnej (RRM)
- Podejście Intrinsic Low-Dimensional Manifold (ILDM) i dalszy rozwój
- Metoda krzywej niezmiennej ograniczonej równowagi krawędziowej obrazu wstępnego.
- Kilka podejść wariacyjnych
- Metoda Computational Singular Perturbation (CSP) i dalszy rozwój.
- Podejście RCCE (Quasi Equilibrium Manifold) i QEM (Quasi Equilibrium Manifold).
- Schemat G.
- Metoda siatek niezmiennych (MIG).
Modelowanie kinetyczne
Modelowanie kinetyczne może być badane w celu wglądu w mechanizmy reakcji rozkładu termicznego podczas spalania różnych materiałów za pomocą np . analizy termograwimetrycznej .
Temperatura

Zakładając doskonałe warunki spalania, takie jak całkowite spalanie w warunkach adiabatycznych (tj. brak strat lub zysków ciepła), można określić adiabatyczną temperaturę spalania. Formuła dająca tę temperaturę opiera się na pierwszej zasadzie termodynamiki i uwzględnia fakt, że ciepło spalania jest w całości wykorzystywane do ogrzewania paliwa, powietrza do spalania lub tlenu oraz gazów spalinowych (powszechnie określanych jako spaliny ).
W przypadku paliw kopalnych spalanych w powietrzu temperatura spalania zależy od wszystkich poniższych czynników:
- wartość opałowa ;
- stechiometryczny stosunek powietrza do paliwa ;
- pojemność ciepło paliwa i powietrza;
- temperatury powietrza i paliwa na wlocie.
Adiabatyczna temperatura spalania (znana również jako adiabatyczna temperatura płomienia ) wzrasta dla wyższych wartości opałowych oraz temperatur powietrza wlotowego i paliwa oraz dla stechiometrycznych stosunków powietrza zbliżających się do jedności.
Najczęściej adiabatyczne temperatury spalania węgla wynoszą około 2200 °C (3992 °F) (dla powietrza wlotowego i paliwa w temperaturze otoczenia i dla ), około 2150 °C (3902 °F) dla oleju i 2000 °C (3632 °F) F) dla gazu ziemnego .
W nagrzewnicach przemysłowych , generatorach pary w elektrowniach i dużych turbinach gazowych , częstszym sposobem wyrażania zużycia więcej niż stechiometrycznego powietrza do spalania jest procentowy nadmiar powietrza do spalania . Na przykład nadmiar powietrza do spalania wynoszący 15 procent oznacza, że stosuje się 15 procent więcej niż wymagane powietrze stechiometryczne.
Niestabilności
Niestabilność spalania to zazwyczaj gwałtowne oscylacje ciśnienia w komorze spalania. Te wahania ciśnienia mogą sięgać nawet 180 dB, a długotrwałe wystawienie na działanie cyklicznego ciśnienia i obciążeń termicznych skraca żywotność elementów silnika. W rakietach, takich jak F1 używane w programie Saturn V, niestabilność doprowadziła do ogromnych uszkodzeń komory spalania i otaczających ją elementów. Ten problem został rozwiązany poprzez przeprojektowanie wtryskiwacza paliwa. W ciekłych silnikach odrzutowych wielkość i rozkład kropel można wykorzystać do złagodzenia niestabilności. Niestabilność spalania jest głównym problemem w naziemnych silnikach turbinowych ze względu na NO
x emisje. Tendencja jest uboga, przy stosunku równoważności mniejszym niż 1, w celu obniżenia temperatury spalania, a tym samym zmniejszenia NO
x emisje; jednak prowadzenie spalania ubogiego sprawia, że jest ono bardzo podatne na niestabilność spalania.
Rayleigha Kryterium stanowi podstawę do analizy termoakustycznego niestabilności spalania i jest oceniany za pomocą indeksu Rayleigha w ciągu jednego cyklu niestabilności
gdzie q' to zaburzenie szybkości uwalniania ciepła, a p' to fluktuacja ciśnienia. Gdy oscylacje wydzielania ciepła są w fazie z oscylacjami ciśnienia, wskaźnik Rayleigha jest dodatni, a wielkość niestabilności termoakustycznej jest zmaksymalizowana. Z drugiej strony, jeśli wskaźnik Rayleigha jest ujemny, to występuje tłumienie termoakustyczne. Kryterium Rayleigha sugeruje, że niestabilność termoakustyczna może być optymalnie kontrolowana przez oscylacje wydzielania ciepła o 180 stopni przesunięte w fazie z oscylacjami ciśnienia o tej samej częstotliwości. Minimalizuje to wskaźnik Rayleigha.
Zobacz też
|
|
Bibliografia
Dalsza lektura
- Poinsota, Thierry'ego; Veynante, Denis (2012). Spalanie teoretyczne i numeryczne (3rd ed.). Europejskie Centrum Badań i Zaawansowanych Kształcenia w Informatyce Naukowej.
- Lackner, Maksymilian; Zima, Franz; Agarwal, Avinash K., wyd. (2010). Podręcznik spalania, zestaw 5 objętości . Wiley-VCH . Numer ISBN 978-3-527-32449-1.
- Baukal, Charles E., wyd. (1998). Spalanie wspomagane tlenem . CRC Naciśnij .
- Glassman, Irvin; Yetter, Richard. Spalanie (wyd. czwarte).
- Zakręty, Stephen (2011). Wprowadzenie do spalania: koncepcje i zastosowania .
- Ragland, Kenneth W; Bryden, Kenneth M. (2011). Inżynieria spalania (wyd. drugie).
- Baukal, Charles E. Jr, wyd. (2013). „Spalanie przemysłowe”. The John Zink Hamworthy Combustion Handbook: Zestaw trzech tomów (druga ed.).
- Gardiner, WC Jr (2000). Chemia spalania w fazie gazowej (wyd. poprawione).
























