Lowastatyna - Lovastatin
 | |
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Mevacor, Altocor, inne |
| Inne nazwy | Monakolina K, Mevinolin |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a688006 |
| Dane licencyjne | |
| Drogi administracji |
Ustami |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Biodostępność | <5% |
| Wiązanie białek | >98% |
| Metabolizm | Wątroba ( substrat CYP3A i CYP2C8 ) |
| Okres półtrwania eliminacji | 2–5 godzin |
| Wydalanie | Kał (83%), mocz (10%) |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CZEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA |
100.115.931 |
| Dane chemiczne i fizyczne | |
| Formuła | C 24 H 36 O 5 |
| Masa cząsteczkowa | 404,547 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
| (zweryfikować) | |
Lowastatyna , sprzedawana między innymi pod marką Mevacor , jest lekiem statynowym, stosowanym w leczeniu wysokiego poziomu cholesterolu we krwi i zmniejszaniu ryzyka chorób sercowo-naczyniowych . Zaleca się jego stosowanie wraz ze zmianą stylu życia. Jest przyjmowany doustnie.
Częste działania niepożądane to biegunka, zaparcia, bóle głowy, bóle mięśni, wysypka i problemy ze snem. Poważne działania niepożądane mogą obejmować problemy z wątrobą , rozpad mięśni i niewydolność nerek . Stosowanie w ciąży może zaszkodzić dziecku i nie zaleca się stosowania w okresie karmienia piersią . Działa poprzez zmniejszenie zdolności wątroby do wytwarzania cholesterolu poprzez blokowanie enzymu reduktazy HMG-CoA .
Lowastatyna została opatentowana w 1979 roku i dopuszczona do użytku medycznego w 1987 roku. Znajduje się na Liście Podstawowych Leków Światowej Organizacji Zdrowia . Jest dostępny jako lek generyczny . W 2019 roku był to 95. najczęściej przepisywany lek w Stanach Zjednoczonych, z ponad 8 milionami recept.
Zastosowania medyczne
Podstawowym zastosowaniem lowastatyny jest leczenie dyslipidemii i zapobieganie chorobom sercowo-naczyniowym . Zaleca się stosować tylko wtedy, gdy inne środki, takie jak dieta, ćwiczenia i redukcja masy ciała, nie poprawiły poziomu cholesterolu.
Skutki uboczne
Lowastatyna jest zwykle dobrze tolerowana, a najczęstszymi działaniami niepożądanymi są, w przybliżeniu malejącej częstości występowania: podwyższenie aktywności fosfokinazy kreatynowej , wzdęcia , ból brzucha, zaparcia, biegunka , bóle mięśni , nudności, niestrawność , osłabienie, niewyraźne widzenie, wysypka, zawroty głowy i skurcze mięśni. Jak wszystkie statyny, rzadko może powodować miopatię , hepatotoksyczność (uszkodzenie wątroby), zapalenie skórno-mięśniowe lub rabdomiolizę . Może to zagrażać życiu, jeśli nie zostanie rozpoznane i leczone w odpowiednim czasie, dlatego każdy niewyjaśniony ból lub osłabienie mięśni podczas stosowania lowastatyny należy niezwłocznie zgłosić lekarzowi. Inne niezbyt częste działania niepożądane, o których należy niezwłocznie poinformować lekarza lub pogotowie ratunkowe, obejmują:
- ból, tkliwość lub osłabienie mięśni
- brak energii
- słabość
- gorączka
- ciemny kolor moczu
- żółtaczka : zażółcenie skóry lub oczu
- ból w prawej górnej części żołądka
- mdłości
- nietypowe krwawienie lub siniaki
- utrata apetytu
- objawy grypopodobne
- wysypka
- pokrzywka
- swędzący
- trudności w oddychaniu lub połykaniu
- obrzęk twarzy, gardła, języka, warg, oczu, dłoni, stóp, kostek lub podudzi
- chrypka
Te mniej poważne skutki uboczne należy nadal zgłaszać, jeśli utrzymują się lub nasilają się:
- zaparcie
- utrata pamięci lub zapominanie
- dezorientacja
Przeciwwskazania
Przeciwwskazania , stany, które uzasadniają wstrzymanie leczenia lowastatyną, obejmują ciążę, karmienie piersią i choroby wątroby. Lowastatyna jest przeciwwskazana w czasie ciąży (kategoria ciąży X); może powodować wady wrodzone, takie jak deformacje szkieletu lub trudności w uczeniu się. Ze względu na możliwość zaburzania metabolizmu lipidów niemowlęcia, lowastatyny nie należy stosować podczas karmienia piersią. Pacjenci z chorobami wątroby nie powinni przyjmować lowastatyny.
Interakcje
Podobnie jak w przypadku atorwastatyny , simwastatyny i innych statyn metabolizowanych przez CYP3A4 , picie soku grejpfrutowego podczas leczenia lowastatyną może zwiększać ryzyko wystąpienia działań niepożądanych. Składniki soku grejpfrutowego, flawonoid naringina lub bergamottyna furanokumaryny hamują in vitro CYP3A4 i mogą odpowiadać za działanie koncentratu soku grejpfrutowego in vivo, zmniejszając klirens metaboliczny lowastatyny i zwiększając jej stężenie w osoczu.
Mechanizm akcji
Lowastatyna jest inhibitorem reduktazy 3-hydroksy-3-metyloglutarylo-koenzymu A (reduktazy HMG-CoA), enzymu, który katalizuje konwersję HMG-CoA do mewalonianu. Mewalonian jest niezbędnym budulcem biosyntezy cholesterolu, a lowastatyna zakłóca jego produkcję, działając jako odwracalny konkurencyjny inhibitor dla HMG-CoA, który wiąże się z reduktazą HMG-CoA. Lowastatyna jest prolekiem , nieaktywnym laktonem w swojej natywnej postaci, w postaci zamkniętego pierścienia gamma-laktonowego, w którym jest podawana, ulega hydrolizie in vivo do postaci otwartego pierścienia β-hydroksykwasu; która jest formą aktywną.
Lowastatyna i inne statyny badano pod kątem ich działania chemoprewencyjnego i chemioterapeutycznego . We wczesnych badaniach nie zaobserwowano takich efektów. Nowsze badania ujawniły pewne efekty chemoprewencyjne i terapeutyczne dla niektórych rodzajów raka, zwłaszcza w połączeniu statyn z innymi lekami przeciwnowotworowymi. Jest prawdopodobne, że takie działanie jest zależna od właściwości statyn zmniejszenie proteasomu aktywność, co prowadzi do gromadzenia się zależnej od cykliny kinazy inhibitory p21 i p27 , a w późniejszym G 1 FAZA zatrzymania, jak pokazano na różnych liniach komórek rakowych.
Historia

Kompaktyna i lowastatyna, naturalne produkty o silnym działaniu hamującym reduktazę HMG-CoA , zostały odkryte w latach 70. XX wieku i wprowadzone do badań klinicznych jako potencjalne leki obniżające poziom cholesterolu LDL .
W 1982 r. podjęto pewne badania kliniczne na małą skalę lowastatyny, produktu naturalnego pochodzenia poliketydowego wyizolowanego z Aspergillus terreus , u pacjentów bardzo wysokiego ryzyka, w których zaobserwowano dramatyczne obniżenie poziomu cholesterolu LDL, przy bardzo niewielu działaniach niepożądanych. Po tym, jak dodatkowe badania dotyczące bezpieczeństwa stosowania lowastatyny na zwierzętach nie wykazały toksyczności typu uważanego za związane z kompaktyną, kontynuowano badania kliniczne.
Badania na dużą skalę potwierdziły skuteczność lowastatyny. Obserwowana tolerancja była nadal doskonała, a lowastatyna została zatwierdzona przez amerykańską FDA w 1987 roku. Była to pierwsza statyna zatwierdzona przez FDA.
Lowastatyna jest również naturalnie wytwarzana przez pewne wyższe grzyby , takie jak Pleurotus ostreatus (boczniak ostrygowy) i blisko spokrewniony Pleurotus spp. Badania nad wpływem boczniaka i jego ekstraktów na poziom cholesterolu zwierząt laboratoryjnych były szeroko zakrojone, chociaż efekt ten został wykazany na bardzo ograniczonej liczbie ludzi.
W 1998 roku FDA wprowadziła zakaz sprzedaży suplementów diety pochodzących z czerwonego ryżu drożdżowego , który naturalnie zawiera lowastatynę, argumentując, że produkty zawierające leki na receptę wymagają zatwierdzenia leku. Sędzia Dale A. Kimball z Sądu Okręgowego Stanów Zjednoczonych dla Dystryktu Utah uwzględnił wniosek producenta Cholestina, firmy Pharmanex, że zakaz wydany przez agencję był nielegalny na mocy Ustawy o Zdrowiu i Edukacji Suplementów Diety z 1994 r., ponieważ produkt był sprzedawany jako suplement diety , a nie narkotyk.
Celem jest obniżenie nadmiernego poziomu cholesterolu do ilości zgodnej z utrzymaniem prawidłowego funkcjonowania organizmu. Cholesterol jest biosyntetyzowany w serii ponad 25 oddzielnych reakcji enzymatycznych, które początkowo obejmują trzy kolejne kondensacje jednostek acetylo-CoA z wytworzeniem sześciowęglowego związku 3-hydroksy-3-metyloglutarylokoenzymu A (HMG CoA). Jest on redukowany do mewalonianu, a następnie przekształcany w serii reakcji do izoprenów, które są budulcem skwalenu , bezpośredniego prekursora steroli, który cyklizuje do lanosterolu (zmetylowanego sterolu) i dalej metabolizowany do cholesterolu. Szereg wczesnych prób blokowania syntezy cholesterolu zaowocował środkami, które hamowały późno szlak biosyntezy między lanosterolem a cholesterolem. Główny, ograniczający szybkość etap szlaku znajduje się na poziomie enzymu mikrosomalnego, który katalizuje konwersję HMG CoA do kwasu mewalonowego i który od kilku lat uważany jest za główny cel interwencji farmakologicznej.
Reduktaza HMG CoA występuje na wczesnym etapie szlaku biosyntezy i jest jednym z pierwszych etapów tworzenia cholesterolu. Hamowanie tego enzymu może prowadzić do akumulacji HMG CoA, rozpuszczalnego w wodzie związku pośredniego, który jest następnie zdolny do łatwego metabolizowania do prostszych cząsteczek. To hamowanie reduktazy prowadziłoby do akumulacji lipofilowych związków pośrednich z formalnym pierścieniem sterolowym.
Lowastatyna była pierwszym specyficznym inhibitorem reduktazy HMG CoA, który został zatwierdzony do leczenia hipercholesterolemii. Pierwszy przełom w wysiłkach mających na celu znalezienie silnego, specyficznego, konkurencyjnego inhibitora reduktazy HMG CoA nastąpił w 1976 roku, kiedy Endo et al. donieśli o odkryciu mewastatyny , wysoce funkcjonalnego metabolitu grzyba, wyizolowanego z kultur Penicillium citrium .
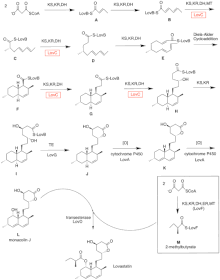
Biosynteza
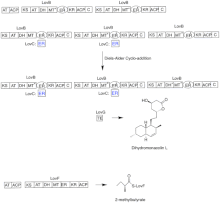
Biosynteza lowastatyny zachodzi poprzez iteracyjny szlak syntazy poliketydowej typu I (PKS). Sześć genów kodujących enzymy niezbędne do biosyntezy lowastatyny to lovB, lovC, lovA, lovD, lovG i lovF. Synteza dihydromonakoliny L wymaga w sumie 9-malonylu Coa. Przebiega szlakiem PKS, aż osiągnie (E) heksaketyd, gdzie ulega cykloaddycji Dielsa-Aldera, tworząc skondensowane pierścienie. Po cyklizacji kontynuuje szlak PKS aż do osiągnięcia (I) nonaketydu, który następnie ulega uwolnieniu z LovB przez tioesterazę kodowaną przez LovG. Dihydromonakolina L, (J), następnie ulega utlenieniu i odwodnieniu przez oksygenazę cytochromu P450 kodowaną przez LovA w celu uzyskania monakoliny J, (L) .
Domena MT z lovB jest aktywna w konwersji ( B) do ( C), gdy przenosi grupę metylową z S-adenozylo-L-metioniny (SAM) do tetraketydu (C) . Ze względu na fakt, że LovB zawiera nieaktywną domenę ER, LovC jest wymagany na określonych etapach w celu uzyskania w pełni zredukowanych produktów. Organizacja domen LovB, LovC, LovG i LovF jest pokazana na Rysunku 2. Nieaktywna domena ER lovB jest pokazana owalem, a gdzie LovC działa w trans do LovB jest pokazana czerwonym prostokątem.
W szlaku równoległym diketydowy łańcuch boczny lowastatyny jest syntetyzowany przez inny wysoce redukujący enzym syntazy poliketydowej typu I kodowany przez LovF. Wreszcie łańcuch boczny, 2-metylomaślan (M) jest kowalencyjnie przyłączony do grupy hydroksylowej C-8 monakoliny J (L) przez transesterazę kodowaną przez LovD, tworząc lowastatynę.
Całkowita synteza
Większą część pracy nad syntezą lowastatyny wykonał w latach 80. M. Hirama. Hirama zsyntetyzował kompaktynę i użył jednego z półproduktów, aby podążać inną drogą do lowastatyny. Sekwencja syntetyczna jest pokazana na poniższych schematach. γ-lakton zsyntetyzowano stosując metodologię Yamada zaczynając od kwasu glutaminowego. Otwarcie laktonu wykonano przy użyciu metanolanu litu w metanolu, a następnie sililowano, otrzymując dającą się oddzielić mieszaninę wyjściowego laktonu i eteru sililowego . Eter sililowy podczas hydrogenolizy, a następnie utleniania Collinsa dał aldehyd. Stereoselektywne wytwarzanie (E, E) -dien przeprowadzono przez dodanie trans-krotylo fenylowv anionu, a następnie reakcję zatrzymano za pomocą Ac 2 O , a następnie redukcyjnej eliminacji octanu sulfon. Kondensacja tego z anionem litowym dimetylofosfonianu dała związek 1. Związek 2 zsyntetyzowano jak pokazano na schemacie w procedurze syntezy. Związki 1 i 2 następnie połączono przy użyciu 1,3 równoważnika wodorku sodu w THF, a następnie ogrzewano w temperaturze wrzenia w chlorobenzenie przez 82 godziny w atmosferze azotu, otrzymując enon 3.
Do uzyskania lowastatyny zastosowano proste reakcje organiczne, jak pokazano na schemacie.
Społeczeństwo i kultura
Naturalne źródła
Lowastatyna to naturalnie występujący związek występujący w małych stężeniach w żywności, takiej jak boczniaki , czerwony ryż drożdżowy i Pu-erh .
Nazwy marek
Mevacor, Advicor (w połączeniu z niacyną ), Altocor, Altoprev
Inne aplikacje
W fizjologii roślin, lowastatyna była czasami stosowana jako inhibitor biosyntezy cytokinin .
Zobacz też
Bibliografia
Zewnętrzne linki
![]() Multimedia związane z Lowastatyny w Wikimedia Commons
Multimedia związane z Lowastatyny w Wikimedia Commons
- „Lowastatyna” . Portal informacyjny o narkotykach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.