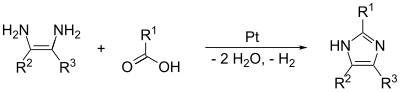Imidazol - Imidazole
|
|
|||
|
|
|||

|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
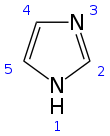
1 H- imidazol |
|||
|
Systematyczna nazwa IUPAC
1,3-Diazacyklopenta-2,4-dien |
|||
| Inne nazwy
1,3-Diazol
Glioksalina (archaiczna) |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA |
100,005,473 |
||
| Numer WE | |||
| KEGG | |||
|
PubChem CID
|
|||
| Numer RTECS | |||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 3 H 4 N 2 | |||
| Masa cząsteczkowa | 68,077 g / mol | ||
| Wygląd | Białe lub bladożółte ciało stałe | ||
| Gęstość | 1,23 g / cm 3 , stałe | ||
| Temperatura topnienia | 89 do 91 ° C (192 do 196 ° F; 362 do 364 K) | ||
| Temperatura wrzenia | 256 ° C (493 ° F, 529 K) | ||
| 633 g / l | |||
| Kwasowość (p K a ) | 6,95 (dla kwasu koniugatu ) | ||
| UV-Vis (λ max ) | 206 nm | ||
| Struktura | |||
| Jednoskośny | |||
| Płaski 5-członowy pierścień | |||
| 3,61 D | |||
| Zagrożenia | |||
| Główne zagrożenia | Żrący | ||
| Arkusz danych dotyczących bezpieczeństwa | Zewnętrzna karta charakterystyki | ||
| H302 , H314 , H360D | |||
| P263 , P270 , P280 , P301 + 310 , P305 + 351 + 338 , P308 + 313 | |||
| Temperatura zapłonu | 146 ° C (295 ° F, 419 K) | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencje Infobox | |||
Imidazol jest związkiem organicznym o wzorze C 3 N 2 H 4 . Jest to biała lub bezbarwna substancja stała rozpuszczalna w wodzie, tworząca lekko zasadowy roztwór. W chemii jest aromatycznym heterocyklem , klasyfikowanym jako diazol i ma niesąsiadujące ze sobą atomy azotu .
Wiele produktów naturalnych, zwłaszcza alkaloidów , zawiera pierścień imidazolowy. Te imidazole dzielić 1,3-C 3 N 2 pierścienia ale funkcji zmieniać podstawników. Ten układ pierścieniowy jest obecny w ważnych biologicznych elementach budulcowych, takich jak histydyna i pokrewny hormon histamina . Wiele leków zawiera pierścień imidazolowy, na przykład niektóre leki przeciwgrzybicze , seria antybiotyków nitroimidazolowych i uspokajający midazolam .
Po połączeniu z pierścieniem pirymidynowym tworzy purynę , która jest najczęściej występującym w naturze heterocyklem zawierającym azot .
Nazwę „imidazol” wymyślił w 1887 r. Niemiecki chemik Arthur Rudolf Hantzsch (1857–1935).
Struktura i właściwości
Imidazol to płaski 5-członowy pierścień. Występuje w dwóch równoważnych formach tautomerycznych , ponieważ wodór może być związany z jednym lub drugim atomem azotu . Imidazolowego jest związkiem bardzo polarnym, o czym świadczy jej elektryczny moment dipolowy 3,67 D . Jest dobrze rozpuszczalny w wodzie. Związek jest klasyfikowany jako aromatyczny ze względu na obecność płaskiego pierścienia zawierającego 6 π-elektronów (parę elektronów z protonowanego atomu azotu i po jednym z każdego z pozostałych czterech atomów pierścienia). Poniżej przedstawiono niektóre struktury rezonansowe imidazolu:
Amfoteryzm
Imidazol jest amfoteryczny . Oznacza to, że może działać zarówno jako kwas, jak i jako zasada. Jako kwas, p K a imidazolu wynosi 14,5, co czyni go mniej kwaśnym niż kwasy karboksylowe, fenole i imidy, ale nieco bardziej kwaśnym niż alkohole. Kwaśny proton jest związany z azotem. Deprotonacja daje anion imidazolidowy, który jest symetryczny. Jako zasada, p K a sprzężonego kwasu (cytowane jako p K BH +, aby uniknąć pomyłki między nimi) wynosi około 7, co czyni imidazol około sześćdziesiąt razy bardziej zasadowym niż pirydyna . Podstawowym miejscem jest azot z samotną parą (nie związany z wodorem). Protonacja daje kation imidazolium, który jest symetryczny.
Przygotowanie
Imidazol został po raz pierwszy opisany w 1858 roku przez niemieckiego chemika Heinricha Debusa , chociaż różne pochodne imidazolu odkryto już w latach czterdziestych XIX wieku. Wykazano, że glioksal , formaldehyd i amoniak kondensują, tworząc imidazol (glioksalinę, jak została pierwotnie nazwana). Ta synteza, chociaż daje stosunkowo niskie wydajności, jest nadal wykorzystywana do wytwarzania C -podstawionych imidazoli.
W jednej modyfikacji mikrofalowej reagentami są benzil , benzaldehyd i amoniak w lodowatym kwasie octowym , tworząc 2,4,5-trifenyloimidazol („lophine”).
Imidazol można syntetyzować wieloma metodami poza metodą Debusa . Wiele z tych syntez można również zastosować do podstawionych imidazoli, zmieniając grupy funkcyjne reagentów. Metody te są zwykle klasyfikowane według liczby reagujących składników.
Jeden składnik
Wiązanie (1,5) lub (3,4) może powstać w wyniku reakcji imidanu i α- aminoaldehydu lub α- aminoacetalu . Poniższy przykład odnosi się do imidazolu gdy R 1 = R 2 oznacza atom wodoru.
Dwuskładnikowy
W (1,2) i (2,3) wiązania mogą być tworzone przez traktowanie 1,2-diamino alkanu w wysokich temperaturach, z alkoholu , aldehydu lub kwasu karboksylowego . Wymagany jest katalizator odwodorniający, taki jak platyna na tlenku glinu .
Wiązania (1,2) i (3,4) można również tworzyć z N -podstawionych α-aminoketonów i formamidu z ogrzewaniem. Produkt będzie 1,4-dipodstawionego imidazol, ale tutaj od R 1 = R 2 oznacza atom wodoru, imidazol sam ten produkt. Wydajność tej reakcji jest umiarkowana, ale wydaje się, że jest to najskuteczniejsza metoda podstawienia 1,4.
Trójskładnikowy
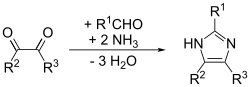
Ta metoda przebiega z dobrą wydajnością dla podstawionych imidazoli. Adaptacja metody Debusa, nazywana syntezą imidazolu Debusa-Radziszewskiego . Materiałami wyjściowymi są podstawiony glioksal, aldehyd, amina i amoniak lub sól amonowa.
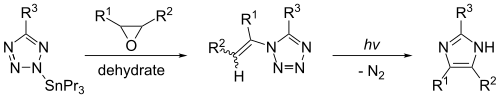
Powstawanie z innych heterocykli
Imidazolu można syntetyzować fotolizy z 1-vinyltetrazole . Ta reakcja da znaczące wydajności tylko wtedy, gdy 1-winylotetrazol jest wytwarzany skutecznie ze związku cynoorganicznego , takiego jak 2-tributylostannotetrazol. Reakcja, pokazany poniżej, wytwarza imidazolu gdy R 1 = R 2 = R 3 = H.
Imidazol może również powstawać w reakcji w fazie pary. Reakcja zachodzi z formamidem , etylenodiaminą i wodorem nad platyną na tlenku glinu i musi zachodzić między 340 a 480 ° C. Tworzy to bardzo czysty produkt imidazolowy.
- Reakcja Van Leusena
Reakcji Van Leusen mogą być również stosowane do wytwarzania imidazoli począwszy od TosMIC i aldiminy . Synteza imidazoli Van Leusena umożliwia otrzymywanie imidazoli z aldimin w reakcji z izocyjankiem tosylometylu (TosMIC). Reakcja została później rozszerzona do dwuetapowej syntezy, w której aldimina jest generowana in situ: trójskładnikowa reakcja Van Leusena (vL-3CR).
Znaczenie biologiczne i zastosowania
Imidazol jest włączany do wielu ważnych związków biologicznych. Najbardziej rozpowszechniony jest aminokwas histydyna , który ma imidazolowy łańcuch boczny . Histydyna jest obecna w wielu białkach i enzymach i odgrywa istotną rolę w strukturze i funkcjach wiązania hemoglobiny . Związki histydynowe na bazie imidazolu odgrywają bardzo ważną rolę w buforowaniu wewnątrzkomórkowym. Histydynę można dekarboksylować do histaminy , która jest również powszechnym związkiem biologicznym. Histamina może powodować pokrzywkę (pokrzywkę), gdy jest wytwarzana podczas reakcji alergicznej . Związek między histydyną i histaminą pokazano poniżej:
Jednym z zastosowań imidazolu jest oczyszczanie białek ze znacznikiem His w chromatografii powinowactwa z unieruchomionym metalem (IMAC). Imidazol służy do wymywania znakowanych białek związanych z jonami niklu przyłączonymi do powierzchni kulek w kolumnie chromatograficznej . Nadmiar imidazolu przechodzi przez kolumnę, co wypiera znacznik His z koordynacji niklu, uwalniając białka ze znacznikiem His.
Imidazol stał się ważną częścią wielu farmaceutyków. Syntetyczne imidazole są obecne w wielu fungicydach i lekach przeciwgrzybiczych , przeciwpierwotniaczych i przeciwnadciśnieniowych . Imidazol jest częścią cząsteczki teofiliny , znajdującej się w liściach herbaty i ziarnach kawy, która stymuluje ośrodkowy układ nerwowy . Jest obecna w leku przeciwnowotworowym merkaptopurynie , która zwalcza białaczkę poprzez zakłócanie aktywności DNA .
Szereg podstawionych imidazoli, w tym klotrimazol , jest selektywnymi inhibitorami syntazy tlenku azotu , co czyni je interesującymi celami leków w stanach zapalnych , chorobach neurodegeneracyjnych i nowotworach układu nerwowego. Inne biologiczne działania farmakoforu imidazolu związane są z regulacją w dół wewnątrzkomórkowych przepływów Ca 2+ i K + oraz interferencją z inicjacją translacji.
Pochodne farmaceutyczne
Podstawione pochodne imidazolu są cenne w leczeniu wielu ogólnoustrojowych zakażeń grzybiczych . Imidazole należą do klasy azolowych leków przeciwgrzybiczych , do których należą ketokonazol , mikonazol i klotrimazol .
Dla porównania inną grupą azoli są triazole, do których należą flukonazol , itrakonazol i worykonazol . Różnica między imidazolami a triazolami polega na mechanizmie hamowania enzymu cytochromu P450 . N3 związku imidazolowego wiąże się z atomem żelaza hemowego cytochromu żelazowego P450, podczas gdy N4 z triazoli wiąże się z grupą hemu. Wykazano, że triazole mają wyższą specyficzność wobec cytochromu P450 niż imidazole, dzięki czemu są silniejsze niż imidazole.
Niektóre pochodne imidazolu wykazują wpływ na owady, na przykład azotan sulkonazolu wykazuje silne działanie przeciwżerowe na trawiące keratynę larwy australijskiego chrząszcza dywanowego Anthrenocerus australis , podobnie jak azotan ekonazolu z pospolitą ćmą odzieżową Tineola bisselliella .
Zastosowania przemysłowe
Sam imidazol ma kilka bezpośrednich zastosowań. Zamiast tego jest prekursorem wielu agrochemikaliów, w tym enilkonazolu , klimbazolu , klotrimazolu , prochlorazu i bifonazolu .
Zastosowanie w badaniach biologicznych
Imidazol jest odpowiednim buforem dla pH 6,2-7,8. Czysty imidazol zasadniczo nie ma absorbancji przy długości fali odpowiadającej białku (280 nm), jednak niższa czystość imidazolu może dać znaczną absorbancję przy 280 nm. Imidazol może wpływać na oznaczenie białka Lowry'ego .
Sole imidazolu
Sole imidazolu, w których pierścień imidazolowy jest kationem, są znane jako sole imidazoliowe (na przykład chlorek imidazoliowy lub azotan ). Sole te powstają w wyniku protonowania lub podstawienia imidazolu przy azocie . Sole te były używane jako ciecze jonowe i prekursory stabilnych karbenów . Sole, w których deprotonowany imidazol jest anionem, są również dobrze znane; sole te są znane jako imidazolany (na przykład imidazolan sodu, NaC 3 H 3 N 2 ).
Powiązane heterocykle
- Benzimidazol , analog ze skondensowanym pierścieniem benzenowym
- Dihydroimidazol lub imidazolina, analog, w którym podwójne wiązanie 4,5- jest nasycone
- Pirol , analog z tylko jednym atomem azotu w pozycji 1
- Oksazol , analog z atomem azotu w pozycji 1 zastąpionym przez tlen
- Tiazol , analog z atomem azotu w pozycji 1 zastąpionym przez siarkę
- Pirazol , analog z dwoma sąsiadującymi atomami azotu
- Triazole , analogi z trzema atomami azotu
Bezpieczeństwo
Imidazol ma niską toksyczność ostrą, na co wskazuje LD 50 wynosząca 970 mg / kg (szczur, doustnie).