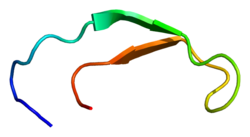Hepcydyna - Hepcidin
| Hepcydyna | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Struktura roztworu hepcydyny-25.
| |||||||||
| Identyfikatory | |||||||||
| Symbol | Hepcydyna | ||||||||
| Pfam | PF06446 | ||||||||
| InterPro | IPR010500 | ||||||||
| SCOP2 | 1m4f / zakres / SUPFAM | ||||||||
| Nadrodzina OPM | 153 | ||||||||
| Białko OPM | 1m4e | ||||||||
| |||||||||
| peptyd przeciwdrobnoustrojowy hepcydyny | |||||||
|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||
| Symbol | HAMP | ||||||
| Gen NCBI | 57817 | ||||||
| HGNC | 15598 | ||||||
| OMIM | 606464 | ||||||
| RefSeq | NM_021175 | ||||||
| UniProt | P81172 | ||||||
| Inne dane | |||||||
| Umiejscowienie | Chr. 19 q13.1 | ||||||
| |||||||
Hepcydyna to białko, które u ludzi jest kodowane przez gen HAMP . Hepcydyna jest kluczowym regulatorem wejścia żelaza do krążenia u ssaków.
W stanach, w których poziom hepcydyny jest nienormalnie wysoki, takich jak stan zapalny , żelazo w surowicy spada z powodu uwięzienia żelaza w makrofagach i komórkach wątroby oraz zmniejszonej absorpcji żelaza w jelitach. Zwykle prowadzi to do anemii z powodu niewystarczającej ilości żelaza w surowicy dostępnej do rozwoju czerwonych krwinek . Kiedy poziom hepcydyny jest nienormalnie niski, tak jak w hemochromatozie , występuje przeciążenie żelazem z powodu zwiększonego wypływu żelaza z przechowywania za pośrednictwem ferroportyny i zwiększonej absorpcji żelaza w jelitach.
Struktura
Hepcydyna występuje jako preprohormon (84 aminokwasy), prohormon (60 aminokwasów) i hormon (25 aminokwasów). W moczu występują również dwudziesto- i 22-aminokwasowe metabolity hepcydyny. Delecja 5 N -końcowych aminokwasów powoduje utratę funkcji. W konwersji prohepcydyny do hepcydyny pośredniczy konwertaza prohormonu furyna . Konwersja ta może być regulowana przez alfa-1 antytrypsynę .
Hepcydyna jest ściśle sfałdowanym polipeptydem o 32% charakterze arkusza beta i strukturze spinki do włosów stabilizowanej 4 wiązaniami dwusiarczkowymi . Strukturę hepcydyny określono metodą NMR w roztworze . Badania NMR wykazały nowy model dla hepcydyny: w temperaturze otoczenia białko przechodzi w interkonwersję między dwiema konformacjami, które mogą być indywidualnie rozdzielone przez zmianę temperatury. Strukturę roztworu hepcydyny określono w temperaturze 325 K i 253 K w przechłodzonej wodzie. Analiza rentgenowska kokryształu z Fab ujawniła strukturę podobną do struktury wysokotemperaturowego NMR.
Funkcjonować
Hepcydyna jest regulatorem metabolizmu żelaza. Hamuje transport żelaza poprzez wiązanie się z kanałem eksportu żelaza , ferroportyną , który znajduje się w podstawno- bocznej błonie plazmatycznej enterocytów jelit i błonie komórkowej komórek siateczkowo- śródbłonkowych ( makrofagów ) , co ostatecznie prowadzi do rozpadu ferroportyny w lizosomach . Hamowanie ferroportyny zapobiega eksportowaniu żelaza z komórki. W enterocytach zapobiega to przenoszeniu żelaza do układu wrotnego wątroby , zmniejszając w ten sposób wchłanianie żelaza z pokarmu. W makrofagach hamowanie ferroportyny powoduje sekwestrację żelaza w komórce. Zwiększona aktywność hepcydyny jest częściowo odpowiedzialna za zmniejszoną dostępność żelaza obserwowaną w anemii przewlekłego zapalenia, takiego jak niewydolność nerek .
Każda z kilku mutacji w hepcydynie powoduje hemochromatozę młodzieńczą . Większość przypadków hemochromatozy młodzieńczej jest spowodowana mutacjami w hemojuwelinie . Mutacje w TMPRSS6 mogą powodować anemię poprzez rozregulowanie hepcydyny.
Hepcydyna wykazuje silne działanie przeciwbakteryjne na Escherichia coli szczep ML35P i Neisseria cinerea oraz słabsze na Staphylococcus epidermidis , Staphylococcus aureus i Streptococcus agalactiae . Działa również na grzyb Candida albicans , ale nie działa na Pseudomonas aeruginosa .
Rozporządzenie
Synteza i wydzielanie hepcydyny przez wątrobę jest kontrolowane przez zapasy żelaza w makrofagach, zapalenie (hepcydyna jest odczynnikiem ostrej fazy ), niedotlenienie i erytropoezę . Makrofagi komunikują się z hepatocytami w celu regulacji uwalniania hepcydyny do krążenia za pośrednictwem ośmiu różnych białek: hemojuweliny , dziedzicznego białka hemochromatozy, receptora transferyny 2 , białka morfogenezy kości 6 (BMP6), matryptazy-2, neogeniny, receptorów BMP i transferyny .
Erytroferron , wytwarzany w erytroblastach, został zidentyfikowany jako hamujący hepcydynę i dostarczający więcej żelaza do syntezy hemoglobiny w sytuacjach takich jak erytropoeza stresowa.
Wykazano, że witamina D zmniejsza poziom hepcydyny w modelach komórkowych patrzących na transkrypcję i gdy jest podawana w dużych dawkach ochotnikom. Optymalne działanie hepcydyny może być uzależnione od odpowiedniej obecności witaminy D we krwi.
Historia
Peptyd został po raz pierwszy zgłoszony w styczniu 1998 przez Valore, E., Park, C. i Ganz, T. w bazie danych SWISS-PROT jako wpis P81172 i nazwany hepcydyna po zaobserwowaniu, że jest wytwarzana w wątrobie („hep-”) i wydaje się mieć właściwości bakteriobójcze („-cide” dla „zabijania”). Szczegółowe opisy zostały opublikowane w latach 2000-2001. Chociaż jest syntetyzowany głównie w wątrobie, mniejsze ilości są syntetyzowane w innych tkankach, takich jak komórki tłuszczowe.
Hepcydyna została po raz pierwszy odkryta w ludzkim moczu i surowicy Wkrótce po tym odkryciu naukowcy odkryli, że produkcja hepcydyny u myszy wzrasta w stanach przeładowania żelazem, a także w stanach zapalnych. Genetycznie zmodyfikowane myszy z nadekspresją hepcydyny padły wkrótce po urodzeniu z ciężkim niedoborem żelaza, co ponownie sugeruje centralną i nie zbędną rolę w regulacji żelaza. Pierwsze dowody na powiązanie hepcydyny ze stanem klinicznym znanym jako anemia stanu zapalnego pochodzi z laboratorium Nancy Andrews w Bostonie, kiedy naukowcy przyjrzeli się tkankom dwóch pacjentów z guzami wątroby z ciężką anemią mikrocytową, która nie reagowała na suplementy żelaza . Okazało się, że tkanka guza nadprodukowała hepcydynę i zawierała duże ilości mRNA hepcydyny . Chirurgiczne usunięcie guzów wyleczyło niedokrwistość.
Podsumowując, odkrycia te sugerują, że hepcydyna reguluje wchłanianie żelaza do organizmu.
Znaczenie kliniczne
Istnieje wiele chorób, w których brak odpowiedniego przyswajania żelaza przyczynia się do niedoboru żelaza i niedokrwistości z niedoboru żelaza . Leczenie będzie zależeć od obecnego poziomu hepcydyny, ponieważ leczenie doustne prawdopodobnie nie będzie skuteczne, jeśli hepcydyna blokuje wchłanianie jelitowe, w takich przypadkach odpowiednie byłoby pozajelitowe podawanie żelaza . Badania wykazały, że pomiar hepcydyny byłby korzystny dla ustalenia optymalnego leczenia, chociaż ponieważ nie jest to powszechnie dostępne, jako marker zastępczy stosuje się białko C-reaktywne (CRP).
Talasemia β , jedna z najczęstszych anemii wrodzonych , wynika z częściowego lub całkowitego braku syntezy β-globiny. Nadmierne wchłanianie żelaza jest jedną z głównych cech β-talasemii i może prowadzić do poważnej zachorowalności i śmiertelności. Seryjne analizy myszy β-talasemicznych wskazują, że poziom hemoglobiny spada z czasem, podczas gdy stężenie żelaza w wątrobie , śledzionie i nerkach znacznie wzrasta. Przeładowanie żelazem wiąże się z niskim poziomem hepcydyny. Pacjenci z β-talasemią mają również niski poziom hepcydyny. Obserwacje doprowadziły naukowców do postawienia hipotezy, że w przypadku β-talasemii wchłania się więcej żelaza niż jest to wymagane w przypadku erytropoezy . Zwiększenie ekspresji hepcydyny u myszy β-talassemicznych ogranicza przeładowanie żelazem, a także zmniejsza tworzenie nierozpuszczalnych globin związanych z błoną i reaktywnych form tlenu oraz poprawia anemię. Myszy ze zwiększoną ekspresją hepcydyny wykazywały również wydłużenie życia czerwonych krwinek , odwrócenie nieefektywnej erytropoezy i splenomegalii oraz wzrost poziomu hemoglobiny całkowitej . Na podstawie tych danych naukowcy zasugerowali, że terapie zwiększające poziomy hepcydyny lub działające jako agoniści hepcydyny mogą pomóc w leczeniu nieprawidłowego wchłaniania żelaza u osób z β-talasemią i zaburzeniami pokrewnymi. W późniejszych badaniach na myszach sugerowano , że erytroferron jest czynnikiem odpowiedzialnym za supresję hepcydyny. Korekta poziomów hepcydyny i żelaza u tych myszy nie poprawiła ich anemii.
Bibliografia
Dalsza lektura
- Camaschella C (2005). „Zrozumienie homeostazy żelaza poprzez analizę genetyczną hemochromatozy i zaburzeń pokrewnych” . Krew . 106 (12): 3710–7. doi : 10.1182/krew-2005-05-1857 . PMID 16030190 .
Zewnętrzne linki
- hepcydyna w Narodowej Bibliotece Medycznej USA Medical Subject Headings (MeSH)
- Intrinsic LifeSciences — ośrodek badawczy hepcydyny, firma BioIron
- Hepcidinanalysis.com - Usługa pomiarów hepcydyny: badania naukowe, pacjenci i badania kliniczne
- Strona banku danych białek
- PDBe-KB zawiera przegląd wszystkich informacji o strukturze dostępnych w PDB dla ludzkiej hepcydyny