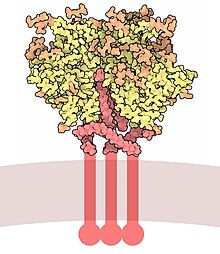
Glikoproteina otoczkowa GP120 - Envelope glycoprotein GP120
| Glikoproteina otoczkowa gp120 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||||
| Symbol | GP120 | ||||||||
| Pfam | PF00516 | ||||||||
| InterPro | IPR000777 | ||||||||
| SCOP2 | 1gc1 / zakres / SUPFAM | ||||||||
| |||||||||
Glikoproteina otoczkowa GP120 (lub gp120 ) jest glikoproteiną eksponowaną na powierzchni otoczki HIV . Został odkryty przez profesorów Tun-Hou Lee i Myrona „Maxa” Essexa z Harvard School of Public Health w 1988 roku. 120 w nazwie pochodzi od masy cząsteczkowej 120 kDa . Gp120 jest niezbędny do wniknięcia wirusa do komórek, ponieważ odgrywa kluczową rolę w przyłączaniu się do specyficznych receptorów na powierzchni komórki . Receptory te to DC- SIGN , proteoglikany siarczanu heparanu i specyficzne interakcje z receptorem CD4 , szczególnie na limfocytach T pomocniczych . Wiązanie z CD4 indukuje początek kaskady zmian konformacyjnych w gp120 i gp41, które prowadzą do fuzji błony wirusowej z błoną komórki gospodarza . Wiązanie z CD4 jest głównie elektrostatyczne, chociaż występują interakcje van der Waalsa i wiązania wodorowe .
Gp120 jest kodowany przez gen env HIV , który ma długość około 2,5 kb i koduje około 850 aminokwasów. Podstawowym produktem env jest białko gp160, które jest rozszczepiane do gp120 (~480 aminokwasów) i gp41 (~345 aminokwasów) w retikulum endoplazmatycznym przez komórkową proteazę furynę . Struktura krystaliczna rdzenia gp120 przedstawia organizację z domeną zewnętrzną, domeną wewnętrzną w odniesieniu do jej końców i arkuszem pomostowym . Gp 120 jest przymocowany do wirusowego membrany lub koperty, poprzez niekowalencyjne wiązania z transbłonowej glikoproteiny , gp41 . Trzy gp120 i gp41 łączą się w trimerze heterodimerów, tworząc wypustkę otoczki, która pośredniczy w przyłączaniu się i wejściu do komórki gospodarza.
Zmienność
Ponieważ gp120 odgrywa istotną rolę w zdolności HIV-1 do wchodzenia do komórek CD4 + , jego ewolucja jest szczególnie interesująca. Wiele przeciwciał neutralizujących wiąże się z miejscami znajdującymi się w regionach zmiennych gp120, więc mutacje w tych regionach będą silnie selekcjonowane. Wykazano, że różnorodność env wzrasta o 1-2% rocznie w grupie M HIV-1, a zmienne jednostki są godne uwagi z powodu szybkich zmian długości sekwencji aminokwasów. Wzrost zmienności gp120 skutkuje znacznie podwyższonymi poziomami replikacji wirusa, wskazując na wzrost sprawności wirusa u osobników zakażonych różnymi wariantami HIV-1. Dalsze badania wykazały, że zmienność potencjalnych miejsc N-glikozylacji (PNGS) również skutkuje zwiększoną sprawnością wirusa. PNGS pozwalają na wiązanie długołańcuchowych węglowodanów z regionami o wysokiej zmienności gp120, więc autorzy stawiają hipotezę, że liczba PNGS w env może wpływać na sprawność wirusa, zapewniając większą lub mniejszą wrażliwość na przeciwciała neutralizujące. Obecność dużych łańcuchów węglowodanowych rozciągających się od gp120 może przesłaniać możliwe miejsca wiązania przeciwciała.
Granice możliwości dodawania i eliminowania PNGS są naiwnie badane przez rosnące populacje wirusów po każdej nowej infekcji. Podczas gdy gospodarz przenoszący rozwinął odpowiedź przeciwciał neutralizujących na gp120, nowo zakażony gospodarz nie rozpoznaje wirusa przez układ odpornościowy. Dane sekwencyjne pokazują, że początkowe warianty wirusa w immunologicznie naiwnym gospodarzu mają niewiele miejsc glikozylacji i krótsze eksponowane zmienne pętle. Może to ułatwić wirusowi zdolność wiązania receptorów komórek gospodarza. Ponieważ układ odpornościowy gospodarza wytwarza przeciwciała przeciwko gp120, ciśnienie immunologiczne wydaje się skłaniać do zwiększonej glikozylacji, szczególnie na odsłoniętych zmiennych pętlach gp120. W konsekwencji, insercje w env , które nadają gp120 więcej PNGS, mogą być lepiej tolerowane przez wirus, ponieważ wyższa gęstość glikanów sprzyja zdolności wirusa do unikania przeciwciał, a tym samym sprzyja wyższej sprawności wirusa. Rozważając, jak bardzo gęstość PNGS może się zmienić teoretycznie, może istnieć górna granica liczby PNGS z powodu hamowania fałdowania gp120, ale jeśli liczba PNGS znacznie się zmniejszy, wirus jest zbyt łatwo wykrywany przez przeciwciała neutralizujące. Dlatego prawdopodobnie ustaliła się stabilizująca równowaga selekcji między niską i wysoką gęstością glikanów. Mniejsza liczba objętościowych glikanów poprawia wydajność replikacji wirusa, a większa liczba odsłoniętych pętli pomaga gospodarzowi uniknąć odporności przez przebranie.
Związek między gp120 a przeciwciałami neutralizującymi jest przykładem dynamiki ewolucyjnej Red Queen . Ciągła adaptacja ewolucyjna jest wymagana, aby białko otoczki wirusa utrzymało sprawność w stosunku do ciągłych adaptacji ewolucyjnych przeciwciał neutralizujących układ odpornościowy gospodarza i odwrotnie, tworząc układ współewoluujący.
Cel szczepionki
Ponieważ wiązanie receptora CD4 jest najbardziej oczywistym etapem infekcji HIV, gp120 był jednym z pierwszych celów badań nad szczepionkami przeciw HIV . Wysiłki zmierzające do opracowania szczepionek przeciwko HIV ukierunkowanych na gp120 zostały jednak utrudnione przez chemiczne i strukturalne właściwości gp120, które utrudniają wiązanie się z nim przeciwciał . gp120 można również łatwo usunąć z powierzchni wirusa i wychwycić przez limfocyty T ze względu na luźne wiązanie z gp41. Zidentyfikowano konserwowany region w glikoproteinie gp120, który jest zaangażowany w metastabilne przyłączanie gp120 do CD4 i celowanie w region niezmienny osiągnięto za pomocą przeciwciała o szerokim spektrum neutralizującym, IgG1-b12.
Badania NIH opublikowane w Science donoszą o wyizolowaniu 3 przeciwciał, które neutralizują 90% szczepów HIV-1 w regionie CD4bs gp120, potencjalnie oferując strategię terapeutyczną i szczepionkową. [1] Jednak większość przeciwciał, które wiążą region CDbs gp120, nie neutralizuje HIV, a rzadkie przeciwciała, takie jak IgG1-b12, mają niezwykłe właściwości, takie jak asymetria ramion Fab lub ich pozycjonowania. O ile szczepionkę na bazie gp120 nie można zaprojektować tak, aby wywoływała przeciwciała o silnie neutralizujących właściwościach przeciwwirusowych, istnieje obawa, że przełomowa infekcja prowadząca do humoralnego wytwarzania wysokich poziomów nieneutralizujących przeciwciał ukierunkowanych na miejsce wiązania CD4 gp120 jest związana z szybszym postępem choroby do AIDS.
Konkurencja
Białko gp120 jest niezbędne podczas początkowego wiązania wirusa HIV z komórką docelową. W konsekwencji wszystko, co wiąże się z gp120 lub jego celami, może fizycznie blokować wiązanie gp120 z komórką. Tylko jeden taki środek, marawirok , który wiąże koreceptor CCR5, jest obecnie licencjonowany i stosowany klinicznie. Żaden środek ukierunkowany na głównego pierwszego partnera interakcji komórkowej gp120, CD4 , nie jest obecnie licencjonowany, ponieważ zakłócanie takiej centralnej cząsteczki układu odpornościowego może powodować toksyczne skutki uboczne, takie jak przeciwciało monoklonalne anty-CD4 OKT4 . Samo namierzenie gp120 okazało się niezwykle trudne ze względu na wysoki stopień zmienności i ekranowania. Fostemsawir (BMS-663068) jest prolekiem fosforanu metylu drobnocząsteczkowego inhibitora BMS-626529, który zapobiega wnikaniu wirusa poprzez wiązanie się z otoczką wirusa gp120 i zakłócanie przyłączania wirusa do receptora CD4 gospodarza.
demencja HIV
Białko wirusa HIV gp120 indukuje apoptozę komórek neuronalnych poprzez hamowanie poziomów furyny i tkankowego aktywatora plazminogenu, enzymów odpowiedzialnych za przekształcanie pBDNF w mBDNF. gp120 indukuje białka śmierci mitochondrialnej, takie jak kaspazy, które mogą wpływać na regulację w górę receptora śmierci Fas prowadząc do apoptozy komórek neuronalnych, gp120 indukuje stres oksydacyjny w komórkach neuronalnych, a także wiadomo, że aktywuje STAT1 i indukuje interleukiny IL-6 i IL -8 sekrecja w komórkach neuronalnych.
Zobacz też
Bibliografia
Dalsza lektura
- Glikoproteina 120 . ludzkiego wirusa niedoboru odporności
- Vashistha H, Husain M, Kumar D, Singhal PC (2009). „Ekspresja gp120 komórek kanalikowych HIV-1 indukuje aktywację i apoptozę kaspazy 8”. Ren nie . 31 (4): 303–12. doi : 10.1080/08860220902780101 . PMID 19462280 . S2CID 205593494 .
Zewnętrzne linki
- https://web.archive.org/web/20060219135317/http://www.aidsmap.com/en/docs/4406022B-85D7-4A9B-B700-91336CBB6B18.asp
- http://www.mcld.co.uk/hiv/?q=gp120
- http://www.ebi.ac.uk/interpro/IEntry?ac=IPR000777
- Vashistha, H.; Husain, M.; Kumar, D.; Singhal, PC (2009). „Tubular Cell HIV-1 gp120 Ekspresja indukuje aktywację kaspazy 8 i apoptozę”. Niewydolność nerek . 31 (4): 303–312. doi : 10.1080/08860220902780101 . PMID 19462280 . S2CID 205593494 .