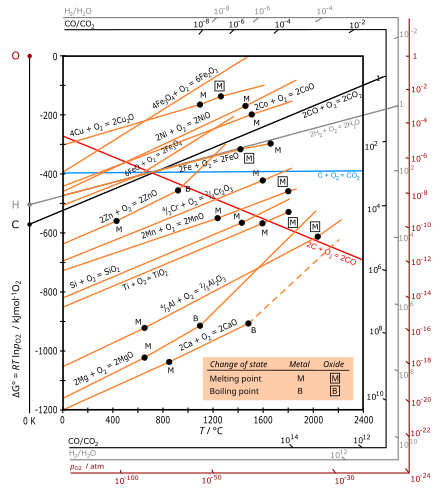
Schemat Ellinghama - Ellingham diagram
Ellingham schemat jest wykresem przedstawiającym zależność temperatury stabilności związków. Analiza ta jest zwykle wykorzystywana do oceny łatwości redukcji tlenków i siarczków metali . Schematy te najpierw skonstruowany przez Harolda Ellingham w 1944. W metalurgii diagram Ellingham służy do prognozowania temperatury równowaga pomiędzy metalem , jej tlenku , oraz tlenu - a co za tym idzie, reakcja metalu z siarki , azotu i innych niebędących -metale . Diagramy są przydatne w przewidywaniu warunków, w jakich rudazostanie zredukowany do jego metalu. Analiza ma charakter termodynamiczny i pomija kinetykę reakcji . Zatem procesy, które według diagramu Ellinghama są korzystne, mogą nadal przebiegać powoli.
Termodynamika
Diagramy Ellinghama są szczególną graficzną formą zasady, że termodynamiczna wykonalność reakcji zależy od znaku Δ G , zmiany swobodnej energii Gibbsa , która jest równa Δ H − T Δ S , gdzie Δ H jest zmianą entalpii i Δ S to zmiana entropii .
Schemat Ellingham wykreśli entalpia wolne zmiany (Δ G ) dla każdej reakcji utleniania, jako funkcji temperatury. Dla porównania różnych reakcji, wszystkie wartości Δ G odnoszą się do reakcji tej samej ilości tlenu, wybranej jako jeden mol O ( 1 ⁄ 2 mol O
2) przez niektórych autorów i jeden kret O
2przez innych. Przedstawiony wykres odnosi się do 1 mola O
2, tak że np. linia utleniania chromu pokazuje Δ G dla reakcji 4 ⁄ 3 Cr(s) + O
2(g) → 2 ⁄ 3 Cr
2O
3(s), co stanowi 2 ⁄ 3 molowej energii Gibbsa tworzenia Δ G f °( Cr
2O
3s).
W powszechnie stosowanych zakresach temperatur metal i tlenek są w stanie skondensowanym (stałym lub ciekłym), a tlen jest gazem o znacznie większej entropii molowej. W przypadku utleniania każdego metalu dominującym wkładem w zmianę entropii (Δ S ) jest usunięcie 1 ⁄ 2 mol O
2, tak że ΔS jest ujemne i mniej więcej równe dla wszystkich metali. Nachylenie wykresów jest zatem dodatnie dla wszystkich metali, przy czym Δ G zawsze staje się bardziej ujemne wraz z niższą temperaturą, a linie dla wszystkich tlenków metali są w przybliżeniu równoległe. Ponieważ reakcje te są egzotermiczne, zawsze stają się wykonalne w niższych temperaturach. W wystarczająco wysokiej temperaturze znak Δ G może się odwrócić (stając się dodatni), a tlenek może spontanicznie redukować się do metalu, jak pokazano dla Ag i Cu.
W przypadku utleniania węgla czerwona linia oznacza tworzenie CO: C(s) + 1 ⁄ 2 O
2(g) → CO(g) ze wzrostem liczby moli gazu, prowadzącym do dodatniego Δ S i ujemnego nachylenia. Niebieska linia tworzenia CO
2jest w przybliżeniu pozioma, ponieważ reakcja C(s) + O
2(g) → CO
2(g) pozostawia niezmienioną liczbę moli gazu tak, że Δ S jest małe.
Tak jak w przypadku jakiegokolwiek przewidywania reakcji chemicznych opartych na czysto termodynamicznych względów spontaniczna reakcja może być bardzo długi, jeżeli jeden lub więcej etapów w szlaku reakcji bardzo wysokie energie aktywacji E A .
Jeśli obecne są dwa metale, należy wziąć pod uwagę dwie równowagi. Powstanie tlenek o bardziej ujemnym Δ G , a drugi tlenek zostanie zredukowany.
Cechy diagramu
- Krzywe na diagramach Ellinghama dla tworzenia tlenków metali są w zasadzie liniami prostymi o dodatnim nachyleniu. Nachylenie jest proporcjonalne do Δ S , które jest praktycznie stałe wraz z temperaturą.
- Im niższa pozycja linii metalu na diagramie Ellinghama, tym większa jest stabilność jego tlenku. Na przykład stwierdzono, że linia dla Al (utlenianie aluminium ) znajduje się poniżej linii dla Fe (tworzenie Fe
2O
3). - Stabilność tlenków metali spada wraz ze wzrostem temperatury. Wysoce niestabilne tlenki, takie jak Ag
2O i HgO łatwo ulegają rozkładowi termicznemu. - Energia swobodna tworzenia dwutlenku węgla ( CO
2) jest prawie niezależna od temperatury, podczas gdy tlenek węgla (CO) ma nachylenie ujemne i przecina CO
2linia blisko 700 °C. Zgodnie z reakcją Boudouarda tlenek węgla jest dominującym tlenkiem węgla w wyższych temperaturach (powyżej około 700 °C), a im wyższa temperatura (powyżej 700 °C), tym skuteczniejszy jest węgiel redukujący (reduktor). - Jeśli porówna się krzywe dla dwóch metali w danej temperaturze, metal z niższą energią swobodną utleniania Gibbsa na wykresie zredukuje tlenek o wyższej energii swobodnej Gibbsa tworzenia. Na przykład metaliczne aluminium może redukować tlenek żelaza do metalicznego żelaza, przy czym samo aluminium utlenia się do tlenku glinu. (Ta reakcja jest stosowana w termicie ).
- Im większa przerwa między dowolnymi dwiema liniami, tym większa skuteczność środka redukującego odpowiadająca dolnej linii.
- Przecięcie dwóch linii implikuje równowagę oksydacyjno-redukcyjną. Redukcja z zastosowaniem danego redukujący jest dostępny w temperaturach powyżej punktu przecięcia, gdy Δ G linia tego reduktora jest niżej na schemacie niż tlenku metalicznego zostać zmniejszona. W punkcie przecięcia zmiana energii swobodnej dla reakcji wynosi zero, poniżej tej temperatury jest dodatnia i tlenek metalu jest stabilny w obecności reduktora, natomiast powyżej punktu przecięcia energia Gibbsa jest ujemna i tlenek może być zredukowany.
Środki redukujące
W procesach przemysłowych do redukcji tlenków metali często dochodzi w wyniku reakcji karbotermicznej , w której jako czynnik redukujący stosuje się węgiel. Węgiel jest dostępny tanio w postaci węgla , który można przerobić na koks . Gdy węgiel reaguje z tlenem, tworzy gazowe tlenki tlenek węgla i dwutlenek węgla , więc termodynamika jego utleniania jest inna niż w przypadku metali: jego utlenianie ma bardziej ujemne Δ G przy wyższych temperaturach (powyżej 700 °C). Węgiel może zatem służyć jako środek redukujący . Wykorzystując tę właściwość, redukcję metali można przeprowadzić jako podwójną reakcję redoks w stosunkowo niskiej temperaturze.
Wykorzystanie diagramów Ellinghamham
Główne zastosowanie diagramów Ellinghama znajduje się w przemyśle metalurgii wydobywczej, gdzie pomaga wybrać najlepszy środek redukujący dla różnych rud w procesie ekstrakcji, oczyszczania i ustalania gatunku do produkcji stali. Pomaga również kierować oczyszczaniem metali, zwłaszcza usuwaniem pierwiastków śladowych. Proces bezpośredniej redukcji wytwarzania żelaza opiera się mocno na wskazówkach diagramów Ellinghama, które pokazują, że sam wodór może redukować tlenki żelaza do metalu.
Środek redukujący hematyt
W rudy żelaza wytapiania , hematyt zostanie zmniejszona w górnej części pieca, gdzie temperatura jest w zakresie 600 - 700 ° C. Wykres Ellinghama wskazuje, że w tym zakresie tlenek węgla działa jako silniejszy czynnik redukujący niż węgiel od czasu procesu
- 2 CO + O
2→ 2 CO
2
ma bardziej ujemną zmianę energii swobodnej niż proces:
- 2 C + O
2 → 2 CO.
W górnej części wielkiego pieca hematyt jest redukowany przez CO (wytwarzany przez utlenianie koksu niżej na dnie wielkiego pieca, w wyższej temperaturze) nawet w obecności węgla – choć dzieje się tak głównie z powodu kinetyki gazowego CO lepiej reagują z rudą.
Nie można stosować środka redukującego tlenek chromu-węgiel
Krzywa Ellinghama dla reakcji 2C(s) + O
2(g) → 2CO(g) opada i spada poniżej krzywych dla wszystkich metali. W związku z tym węgiel może normalnie działać jako środek redukujący dla wszystkich tlenków metali w bardzo wysokich temperaturach. Jednak chrom powstający w tych temperaturach reaguje z węglem, tworząc jego węglik, co nadaje otrzymanemu metalowi chromu niepożądane właściwości. Stąd do wysokotemperaturowej redukcji tlenku chromu nie można stosować węgla.
Proces termiczny aluminium
Krzywa Ellinghama dla aluminium leży poniżej krzywych większości metali, takich jak chrom , żelazo itp. Fakt ten wskazuje, że aluminium można stosować jako czynnik redukujący tlenki wszystkich tych metali. Wynik ten ilustruje się następująco:
Swobodne energie powstawania tlenku chromu(III) i tlenku glinu na mol zużytego tlenu wynoszą odpowiednio -541 kJ i -827 kJ. Procesy to:
-
( 1 )
-
( 2 )
Drugie równanie minus pierwsze równanie daje:
-
( 3 )
Tak więc tlenek glinu jest bardziej stabilny niż tlenek chromu (przynajmniej w normalnych temperaturach, a właściwie aż do temperatur rozkładu tlenków). Ponieważ zmiana energii swobodnej Gibbsa jest ujemna, aluminium może redukować tlenek chromu.
W pirometalurgii aluminium stosuje się jako czynnik redukujący w procesie aluminotermicznym lub termitowym do ekstrakcji chromu i manganu poprzez redukcję ich tlenków.
Rozszerzenia na inne reakcje w fazie gazowej
Koncepcję wykreślania energii swobodnych reakcji różnych pierwiastków z danym reagentem w fazie gazowej można rozszerzyć poza reakcje utleniania. Oryginalna praca Ellinghama wyraźnie dotyczyła redukcji tlenu i siarki w procesach metalurgicznych i przewidywała użycie takich diagramów dla innych związków, w tym chlorków, węglików i siarczanów. Koncepcja ta jest ogólnie użyteczna do badania porównawczej stabilności związków w zakresie ciśnień cząstkowych i temperatur. Konstrukcja diagramu Ellinghama jest szczególnie przydatna podczas badania stabilności związków w obecności reduktora. Diagramy Ellinghama są teraz dostępne dla bromków, chlorków, fluorków, wodorków, jodków, azotków, tlenków, siarczków, selenków i tellurków.
Bibliografia
Linki zewnętrzne
- Interaktywne diagramy Ellingham na Uniwersytecie Stanowym w San José
- Samouczek dotyczący diagramu Ellinghama i diagram interaktywny ( Uniwersytet Cambridge )