Clytia hemisphaerica -Clytia hemisphaerica
| Clytia hemisphaerica | |
|---|---|

|
|
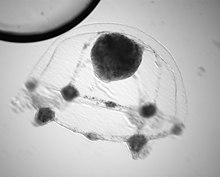
| Planula stadium C. hemisphaerica | |
|
Klasyfikacja naukowa |
|
| Królestwo: | Animalia |
| Gromada: | Cnidaria |
| Klasa: | hydrozoa |
| Zamówienie: | Leptothecata |
| Rodzina: | Campanulariidae |
| Rodzaj: | Klitia |
| Gatunek: |
C. hemisphaerica
|
| Nazwa dwumianowa | |
|
Clytia hemisphaerica (Lineusz, 1767)
|
|
Clytia hemisphaerica to mały hydrozoan -group cnidarian , około 1 cm średnicy, które znajduje się na Morzu Śródziemnym i na północno-wschodnim Atlantyku. Clytia ma typową dla Hydrozoa swobodnie pływającą formę meduzy, a także polipy rozmnażające się wegetatywnie.
Clytia hemisphaerica okazała się obiecującym organizmem modelowym, ponieważ jej cykl życiowy, niewielkie rozmiary i stosunkowo łatwa konserwacja sprawiają, że sprzyja ona eksperymentalnej manipulacji i konserwacji w warunkach laboratoryjnych. Niektóre przykłady badań już przeprowadzonych w Clytia obejmują badania dotyczące rozwoju embrionalnego, zróżnicowane wzorce ekspresji genów na etapach życia i gojenie się ran. Genom Clytia został w pełni zsekwencjonowany w marcu 2019 roku.
Anatomia i cykl życia
Clytia hemisphaerica rozmnaża się płciowo. Jaja owulowane są zapłodnione zewnętrznie i potrzebują około 24 godzin, aby rozwinąć się w planlę . Rzęsowana planula będzie swobodnie pływać, aż odpowiednie sygnały zewnętrzne, na przykład eksperymentalne leczenie CsCl, nie uruchomią procesu metamorficznego. Planla może przejść metamorfozę w polip już trzy dni po zapłodnieniu. Po otrzymaniu odpowiedniego sygnału zewnętrznego, planla przestaje pływać i przyczepia się do podłoża za pomocą bieguna aboralnego lub aboralno-bocznego (który wcześniej był przednim końcem pływającej planuli). Po przyczepieniu się do podłoża, planla kurczy się wzdłuż osi ustno-aoralnej, tworząc w ten sposób spłaszczone mocowanie, aby zakotwiczyć się w podłożu. Gdy planula jest bezpiecznie osadzona na podłożu, łodyga wyrasta z uchwytu, a ostatecznie na przednim końcu łodygi tworzy się hydrant, znany również jako gastrozooid (pojedynczy polip specjalizujący się w żerowaniu). Na tym etapie planla jest obecnie uważana za polip pierwotny, a polip ten może rozmnażać się wegetatywnie, rozszerzając swój stolon, tworząc połączoną kolonię wielu polipów. Kolonie polipów są zasadniczo uważane za nieśmiertelne; tak długo, jak otrzymują odpowiednie składniki odżywcze, mogą stale zastępować stare części i rozszerzać się na swoim podłożu. Oprócz żerujących gastrozooidów, dojrzała kolonia polipów ma reprodukcyjne gonozooidy, które wytwarzają meduzę dziecka przez pączkowanie. Te meduzy osiągają dojrzałość po 2-3 tygodniach.
Jak większość parzydełkowców, Clytia ma stosunkowo prostą morfologię. Jednak pomimo tego, że zawiera stosunkowo niewiele typów komórek i brakuje im skomplikowanych struktur narządowych, meduza ma znacznie większą złożoność anatomiczną niż jej forma polipowa. Dorosła meduza ma średnio 1 cm średnicy. Są prawie całkowicie przezroczyste, ich gonady, kanały promieniowe, krótki brzuch i czterowargowe usta są ich najlepiej widocznymi strukturami anatomicznymi. Każda meduza ma cztery gonady umieszczone w połowie każdego kanału promieniowego endodermy. Same gonady są przezroczyste, co pozwala na wizualizację znajdujących się w nich oocytów.
Każda meduza ma zazwyczaj około 32 macek, z których każda jest pokryta żądlącymi komórkami nematocytów . Te nematocyty są uważane za wyspecjalizowane komórki nerwowe, mimo że składają się z kapsułki ciśnieniowej (nematocysty), szybkostrzelnej strzałki podobnej do harpuna i śmiercionośnych toksyn przeznaczonych do zabijania ofiar. Układ nerwowy Klitia jest dobrze zorganizowany i wysoce wyspecjalizowany. Dwa równoległe skondensowane pierścienie nerwowe biegną wokół obwodu dzwonu meduzy; pierścienie zewnętrzne są odpowiedzialne za integrację bodźców czuciowych, podczas gdy pierścień wewnętrzny koordynuje reakcje motoryczne. Pomiędzy mackami znajdują się również wyspecjalizowane narządy równowagi, zwane statocystami. Meduza ma również mięśnie gładkie i prążkowane, które pozwalają na skurcze niezbędne do płynnego pływania w wodzie.
Zastosowanie badawcze
Ponieważ C. hemisphaerica przechodzi przez etapy planula, polipa i meduzy podczas swojego cyklu życiowego, jest uważany za dobry model do badania, w jaki sposób jeden genom może wytwarzać zmienne fenotypy. Jest to szczególnie przydatne, biorąc pod uwagę, że dwa z bardziej powszechnych organizmów modelowych Cnidarian, Hydra i Nematostella , nie mają tego samego „pełnego” cyklu życiowego, który zmienia się między polipem wegetatywnym a rozmnażaniem płciowym, swobodnie pływającą formą meduzy.
Clytia ma cechy, które sprawiają, że jest korzystna dla hodowli laboratoryjnych i manipulacji eksperymentalnych. Wszystkie etapy cyklu życia Clytia można odtworzyć w warunkach laboratoryjnych; kolonie polipów, ze względu na ich zasadniczo nieśmiertelny charakter, są łatwe w utrzymaniu, a dorosła meduza może być karmiona larwami artemii . Dorosłe samce i samice meduzy odradzają się codziennie i mogą być wprowadzane w kontrolowanych warunkach oświetleniowych, aby odradzać się w określonych godzinach. Oocyty, jaja, zarodki i planle Clytia są łatwo wizualizowane pod mikroskopem i, podobnie jak w popularnych organizmach modelowych, takich jak jeżowce, zygoty C. hemisphaerica są stosunkowo duże (około 200 μm średnicy) i można je mikroiniekcje do tworzenia transgenicznych planuli, kolonii polipów i meduzy. Klitia jest również wyjątkowa pod tym względem, że jej gonady mogą działać autonomicznie; gonada oddzielona od dorosłej meduzy będzie podlegać rozwojowi oocytów i owulacji pod wpływem tych samych sygnałów świetlnych, co gonada nadal przyczepiona do meduzy. Clytia medusa, które są produkowane z pojedynczej kolonii polipów, są również genetycznie identyczne, co stanowi ogromną zaletę w analizie funkcji genów i sekwencjonowaniu genomu.
Parzydełka znane są ze zdolności do szybkiego gojenia i regeneracji tkanek, co posiada również C. hemisphaerica . To sprawia, że Clytia jest idealnym kandydatem do badania dynamiki regeneracji tkanek i gojenia się ran nabłonkowych in vivo, ponieważ niewielki rozmiar organizmu pozwala na filmowanie procesu gojenia pod mikroskopem w czasie rzeczywistym.