Przełyk Barretta - Barrett's esophagus
| Przełyk Barretta | |
|---|---|
| Inne nazwy | Przełyk Barretta, anomalia Allison-Johnstone, dolny przełyk wyściełany nabłonkiem walcowatym (CELLO) |
 | |
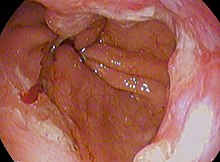
| Obraz endoskopowy przełyku Barretta, czyli obszaru ciemnoczerwono-brązowej błony śluzowej u podstawy przełyku. (Biopsje wykazały metaplazję jelit .) | |
| Specjalność |
Gastroenterologia Chirurgia ogólna |
| Objawy | Mdłości |
Przełyk Barretta jest stanem, w którym występuje nieprawidłowa ( metaplastyczna ) zmiana w komórkach błony śluzowej wyściełającej dolną część przełyku , od prawidłowego nabłonka wielowarstwowego płaskiego do prostego nabłonka walcowatego z przeplatanymi komórkami kubkowymi, które normalnie występują tylko w jelicie cienkim , i jelita grubego . Uważa się , że ta zmiana jest stanem przednowotworowym , ponieważ wiąże się z wysoką częstością dalszego przejścia do gruczolakoraka przełyku , nowotworu często prowadzącego do śmierci .
Uważa się, że główną przyczyną przełyku Barretta jest adaptacja do przewlekłej ekspozycji na kwasy spowodowane refluksowym zapaleniem przełyku. Przełyk Barretta diagnozuje się za pomocą endoskopii : obserwując charakterystyczny wygląd tego stanu poprzez bezpośrednią kontrolę dolnego przełyku; następnie badanie mikroskopowe tkanki z obszaru dotkniętego chorobą uzyskanego z biopsji . Komórki przełyku Barretta dzielą się na cztery kategorie: dysplazja niedysplastyczna, dysplazja niskiego stopnia, dysplazja wysokiego stopnia i rak szczery . Dysplazja dużego stopnia i wczesne stadia gruczolakoraka mogą być leczone poprzez resekcję endoskopową lub ablację częstotliwością radiową . Późniejsze stadia gruczolakoraka można leczyć za pomocą resekcji chirurgicznej lub paliatywnej . Osoby z dysplazją niedysplastyczną lub o niskim stopniu zaawansowania są leczone przez coroczną obserwację endoskopową lub leczenie za pomocą ablacji częstotliwościami radiowymi. W przypadku dysplazji wysokiego stopnia ryzyko zachorowania na raka może wynosić 10% na pacjentorok lub więcej.
Częstość występowania gruczolakoraka przełyku znacznie wzrosła w świecie zachodnim w ostatnich latach. Stan ten występuje u 5–15% pacjentów zgłaszających się po pomoc medyczną z powodu zgagi ( choroba refluksowa przełyku , GERD), chociaż duża podgrupa pacjentów z przełykiem Barretta jest bezobjawowa. Stan nosi imię chirurga Normana Barretta (1903–1979), mimo że stan ten został pierwotnie opisany przez Philipa Rowlanda Allisona w 1946 roku.
Symptomy i objawy
Zmiana z komórek prawidłowych na przednowotworowe wskazuje, że przełyk Barretta nie powoduje żadnych szczególnych objawów. Przełyk Barretta wiąże się jednak z następującymi objawami:
- częsta i długotrwała zgaga
- kłopoty z połykaniem ( dysfagia )
- krwawe wymioty ( krwawe wymioty )
- ból pod mostkiem w miejscu, gdzie przełyk styka się z żołądkiem
- niezamierzona utrata wagi, ponieważ jedzenie jest bolesne ( odynofagia )
Ryzyko rozwoju przełyku Barretta zwiększa się w przypadku otyłości centralnej (w porównaniu z otyłością obwodową). Dokładny mechanizm jest niejasny. Różnica w rozmieszczeniu tłuszczu wśród mężczyzn (bardziej centralna) i kobiet (bardziej peryferyjna) może wyjaśniać zwiększone ryzyko u mężczyzn.
Patofizjologia

Przełyk Barretta występuje z powodu przewlekłego stanu zapalnego. Główną przyczyną przewlekłego zapalenia jest choroba refluksowa przełyku, GERD (UK: GORD). W tej chorobie kwaśny żołądek, żółć i jelito cienkie oraz treść trzustki powodują uszkodzenie komórek dolnego przełyku. To z kolei wywołuje korzyść w przypadku komórek bardziej odpornych na te szkodliwe bodźce, w szczególności komórek macierzystych wykazujących ekspresję HOXA13 , które charakteryzują się cechami dystalnymi (jelitowymi) i przewyższają normalne komórki nabłonka płaskiego.
Mechanizm ten wyjaśnia również selekcję komórek HER2/neu (zwanych również ERBB2) i nadekspresją (uzależnionych od linii) komórek nowotworowych w procesie karcynogenezy oraz skuteczność terapii celowanej przeciwko receptorowi Her-2 za pomocą trastuzumabu ( Herceptin ) w leczenie gruczolakoraków na połączeniu żołądkowo-przełykowym.
Naukowcy nie są w stanie przewidzieć, kto ze zgagą rozwinie przełyk Barretta. Chociaż nie istnieje związek między nasileniem zgagi a rozwojem przełyku Barretta, istnieje związek między przewlekłą zgagą a rozwojem przełyku Barretta. Czasami ludzie z przełykiem Barretta nie mają żadnych objawów zgagi.
Niektóre anegdotyczne dowody wskazują, że osoby z zaburzeniami odżywiania bulimia są bardziej podatne na rozwój przełyku Barretta, ponieważ bulimia może powodować silny refluks żołądkowy, a także dlatego, że przeczyszczanie zalewa również przełyk kwasem. Jednak związek między bulimią a przełykiem Barretta pozostaje nieudowodniony.
Diagnoza



Do postawienia diagnozy wymagane są zarówno wyniki makroskopowe (z endoskopii), jak i mikroskopowe. Przełyk Barretta charakteryzuje się obecnością nabłonka walcowatego w dolnej części przełyku, zastępującego normalny nabłonek płaskonabłonkowy – przykład metaplazji . Wydzielniczy nabłonek walcowaty może być bardziej odporny na erozyjne działanie wydzieliny żołądkowej; jednak ta metaplazja powoduje zwiększone ryzyko gruczolakoraka.
Ekranizacja
Endoskopia przesiewowa jest zalecana u mężczyzn w wieku powyżej 60 lat, u których występują objawy refluksu, które utrzymują się przez długi czas i nie można ich kontrolować za pomocą leczenia. Wśród osób, które nie mogą żyć dłużej niż 5 lat, nie zaleca się przeprowadzania badań przesiewowych.
Protokół Seattle jest powszechnie stosowany w endoskopii w celu uzyskania biopsji endoskopowych do badań przesiewowych, pobieranych co 1 do 2 cm od połączenia żołądkowo-przełykowego.
Metaplazja jelit
Obecność komórek kubkowych, zwanych metaplazją jelitową, jest niezbędna do postawienia diagnozy przełyku Barretta. Dzieje się tak często w obecności innych metaplastycznych komórek słupkowych, ale tylko obecność komórek kubkowych jest diagnostyczna. Metaplazja jest wyraźnie widoczna przez gastroskop , ale próbki biopsyjne muszą zostać zbadane pod mikroskopem, aby określić, czy komórki mają charakter żołądkowy czy okrężnicy. Metaplazja okrężnicy jest zwykle identyfikowana przez znalezienie komórek kubkowych w nabłonku i jest niezbędna do postawienia prawdziwej diagnozy.
Znanych jest wiele histologicznych imitacji przełyku Barretta (tj. komórki kubkowe występujące w nabłonku przejściowym prawidłowych przewodów gruczołu podśluzówkowego przełyku, „komórki rzekomożołądkowe”, w których obfita mucyna typu dołkowego (żołądkowego) symuluje prawdziwe komórki kubkowe mucyny kwasowej). Ocena związku z gruczołami podśluzówkowymi i nabłonkiem typu przejściowego z badaniem wielu poziomów przez tkankę może pozwolić patologowi na wiarygodne odróżnienie komórek kubkowych przewodów podśluzówkowych od prawdziwego przełyku Barretta (wyspecjalizowana metaplazja kolumnowa). Barwnik histochemiczny błękit Alcian pH 2,5 jest również często stosowany do odróżnienia prawdziwych mucyn jelitowych od ich histologicznych naśladowców. Ostatnio do identyfikacji prawdziwych komórek metaplastycznych typu jelitowego zastosowano również analizę immunohistochemiczną z użyciem przeciwciał przeciwko CDX-2 (specyficznych dla pochodzenia jelitowego z jelita środkowego i tylnego). Białko AGR2 jest podwyższone w przełyku Barretta i może być stosowane jako biomarker do odróżniania nabłonka Barretta od normalnego nabłonka przełyku.
Obecność metaplazji jelitowej w przełyku Barretta stanowi marker progresji metaplazji w kierunku dysplazji i ostatecznie gruczolakoraka. Ten czynnik w połączeniu z dwiema różnymi ekspresją immunohistochemiczną p53, Her2 i p16 prowadzi do dwóch różnych ścieżek genetycznych, które prawdopodobnie prowadzą do dysplazji w przełyku Barretta. Również jelitowe komórki metaplastyczne mogą być dodatnie dla CK 7+/CK20-.
Dysplazja nabłonka
Po postawieniu wstępnej diagnozy przełyku Barretta osoby dotknięte chorobą przechodzą coroczny nadzór w celu wykrycia zmian wskazujących na większe ryzyko progresji do raka: rozwój dysplazji nabłonkowej (lub „ śródnabłonkowej neoplazji ”). Wśród wszystkich zmian metaplastycznych około 8% było związanych z dysplazją. szczególnie niedawne badanie wykazało, że zmiany dysplastyczne były zlokalizowane głównie w tylnej ścianie przełyku.
W ocenie dysplazji wśród patologów obserwuje się znaczną zmienność. Ostatnio towarzystwa gastroenterologii i patologii przewodu pokarmowego zaleciły, aby przed ostatecznym leczeniem pacjentów każde rozpoznanie dysplazji wysokiego stopnia u Barretta zostało potwierdzone przez co najmniej dwóch stypendystów patologów z zakresu przewodu pokarmowego. Aby uzyskać większą dokładność i powtarzalność, zaleca się również przestrzeganie międzynarodowych systemów klasyfikacji, takich jak „klasyfikacja wiedeńska” neoplazji nabłonkowej przewodu pokarmowego (2000).
Kierownictwo
Wiele osób z przełykiem Barretta nie ma dysplazji. Towarzystwa medyczne zalecają, aby w przypadku, gdy pacjent ma przełyk Barretta, a ostatnie dwa badania endoskopowe i biopsyjne potwierdziły brak dysplazji, to pacjent nie powinien mieć kolejnej endoskopii w ciągu trzech lat.
Często zaleca się endoskopową obserwację osób z przełykiem Barretta, chociaż niewiele bezpośrednich dowodów potwierdza tę praktykę. Opcje leczenia dysplazji wysokiego stopnia obejmują chirurgiczne usunięcie przełyku ( esophagectomy ) lub zabiegi endoskopowe, takie jak endoskopowa resekcja błony śluzowej lub ablacja (zniszczenie).
Ryzyko nowotworu złośliwego jest najwyższe w Stanach Zjednoczonych u mężczyzn rasy kaukaskiej powyżej pięćdziesiątego roku życia z objawami powyżej pięciu lat. Aktualne zalecenia obejmują rutynową endoskopię i biopsję (poszukiwanie zmian dysplastycznych ). Chociaż w przeszłości lekarze stosowali uważne wyczekiwanie, nowo opublikowane badania potwierdzają rozważenie interwencji w przełyku Barretta. Ablacja falami radiowymi za pomocą balonu , wynaleziona przez Ganza, Sterna i Zelicksona w 1999 roku, jest nową metodą leczenia przełyku Barretta i dysplazji i była przedmiotem wielu opublikowanych badań klinicznych. Wyniki wskazują, że ablacja częstotliwościami radiowymi ma skuteczność 90% lub większą w odniesieniu do całkowitego usunięcia przełyku Barretta i dysplazji z trwałością do pięciu lat i korzystnym profilem bezpieczeństwa.
Nie udowodniono, że operacja antyrefluksowa zapobiega rakowi przełyku. Jednak wskazuje na to, że inhibitory pompy protonowej są skuteczne w ograniczaniu progresji raka przełyku. Leczenie laserowe stosuje się w przypadku ciężkiej dysplazji, natomiast jawne nowotwory złośliwe mogą wymagać zabiegu chirurgicznego , radioterapii lub chemioterapii ogólnoustrojowej . Niedawne pięcioletnie badanie z randomizacją wykazało, że terapia fotodynamiczna z użyciem fotofrinu jest statystycznie bardziej skuteczna w eliminowaniu obszarów wzrostu dysplastycznego niż samo zastosowanie inhibitora pompy protonowej.
Obecnie nie ma wiarygodnego sposobu na ustalenie, u których pacjentów z przełykiem Barretta rozwinie się rak przełyku , chociaż ostatnie badania wykazały, że wykrycie trzech różnych nieprawidłowości genetycznych było związane z aż 79% szansą na zachorowanie na raka w ciągu sześciu lat.
Endoskopowa resekcja błony śluzowej również została oceniona jako technika postępowania. Dodatkowo operacja znana jako fundoplikacja Nissena może zmniejszyć cofanie się kwasu z żołądka do przełyku.
W różnych badaniach niesteroidowe leki przeciwzapalne ( NLPZ ), takie jak aspiryna , wykazały dowody na zapobieganie rakowi przełyku u osób z przełykiem Barretta. Jednak żadne z tych badań nie było randomizowanymi, kontrolowanymi placebo próbami , które są uważane za złoty standard oceny interwencji medycznej. Ponadto nie jest jeszcze znana najlepsza dawka NLPZ w profilaktyce raka.
Rokowanie
Przełyk Barretta jest stanem przednowotworowym , a nie złośliwym. Jego złośliwe następstwo, gruczolakorak połączenia przełykowo-żołądkowego , ma śmiertelność ponad 85%. Ryzyko rozwoju gruczolakoraka przełyku u osób z przełykiem Barretta oszacowano na 6-7 na 1000 osobolat, ale badanie kohortowe 11028 pacjentów z Danii opublikowane w 2011 r. wykazało częstość występowania tylko 1,2 na 1000 osobolat ( 5,1 na 1000 osobolat u pacjentów z dysplazją, 1,0 na 1000 osobolat u pacjentów bez dysplazji).
Względne ryzyko raka gruczołowego przełyku wynosi około 10 u chorych z przełykiem Barretta, w porównaniu do populacji ogólnej. Większość pacjentów z rakiem przełyku przeżywa mniej niż rok.
Epidemiologia
Częstość występowania w Stanach Zjednoczonych wśród mężczyzn rasy kaukaskiej jest ośmiokrotnie większa niż wśród kobiet rasy kaukaskiej i pięć razy większa niż wśród mężczyzn pochodzenia afroamerykańskiego. Ogólnie stosunek płci męskiej do żeńskiej w przełyku Barretta wynosi 10:1. W kilku badaniach oszacowano częstość występowania przełyku Barretta w populacji ogólnej na 1,3% do 1,6% w dwóch populacjach europejskich (włoskich i szwedzkich) oraz 3,6% w populacji koreańskiej.
Historia
Nazwa schorzenia pochodzi od australijskiego chirurga torakochirurga Normana Barretta (1903-1979), który w 1950 r. twierdził, że wrzody znajdują się poniżej połączenia nabłonkowo-kolumnowego … reprezentują wrzody żołądka w „torbie żołądka … wciągniętego przez tkankę bliznowatą do śródpiersia ” … stanowiący przykład „wrodzonego krótkiego przełyku”′. W przeciwieństwie do tego Philip Rowland Allison i Alan Johnstone twierdzili, że stan ten dotyczył „przełyku wyścielonego błoną śluzową żołądka, a nie żołądka wewnątrz klatki piersiowej, jak błędnie sądził Barrett”. Philip Allison, kardiochirurg i katedra chirurgii na Uniwersytecie Oksfordzkim, zasugerował „nazywanie chronicznego krateru wrzodowego przełyku „wrzodem Barretta”, ale dodanie tej nazwy nie oznaczało zgodności z „opisem Barretta przełyku wyścielonego błoną śluzową żołądka jako żołądka”.
Kolejny związek z gruczolakorakiem powstał w 1975 roku.
Bibliografia
Zewnętrzne linki
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |