Izomeraza ksylozy - Xylose isomerase
| izomeraza ksylozy | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Tetramer izomerazy D-ksylozy ze Streptomyces rubiginosus PDB 2glk . Jeden monomer jest zabarwiony strukturą drugorzędową, aby podkreślić architekturę beczki TIM.
| |||||||||
| Identyfikatory | |||||||||
| Nr WE | 5.3.1.5 | ||||||||
| Nr CAS | 9023-82-9 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRIAM | profil | ||||||||
| Struktury WPB | RCSB PDB PDBe Suma PDB | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
W enzymologii , A izomerazy ksylozy ( EC 5.3.1.5 ) jest enzymem , który katalizuje interkonwersję D-ksyloza i D-ksylulozy . Enzym ten należy do rodziny izomeraz , a konkretnie tych wewnątrzcząsteczkowych oksydoreduktaz wzajemnie przekształcających aldozy i ketozy . Izomerazę zaobserwowano obecnie w prawie stu gatunkach bakterii. Ksylozy -isomerases są także powszechnie nazywane fruktozo-izomerazy ze względu na ich zdolność do przechodzić jeden glukozy i fruktozy. Systematyczna nazwa tej klasy enzymów jest D-ksylozy aldozy-ketozy-izomeraza. Inne powszechnie używane nazwy obejmują izomerazę D-ksylozy, ketoizomerazę D-ksylozy i ketoizomerazę D-ksylozy.
Historia
Aktywność izomerazy D-ksylozy po raz pierwszy zaobserwowali Mitsuhashi i Lampen w 1953 roku w bakterii Lactobacillus pentosus . Sztuczna produkcja za pomocą przekształconej bakterii E.coli również odniosła sukces. W 1957 roku Kooi i Marshall zauważyli aktywność izomerazy D-ksylozy na konwersję D-glukozy do D-fruktozy. Obecnie wiadomo, że izomerazy mają szeroką specyficzność substratową. Większość pentoz i niektóre heksozy są substratami dla izomerazy D-ksylozy. Niektóre przykłady to: D-ryboza, L-arabinoza, L-ramnoza i D-alloza.
Konwersja glukozy do fruktozy przez izomerazę ksylozy została po raz pierwszy opatentowana w latach 60. XX wieku, jednak proces ten nie był opłacalny przemysłowo, ponieważ enzymy zawieszono w roztworze, a recykling enzymu był problematyczny. Nieruchoma izomeraza ksylozy utrwalona na stałej powierzchni została po raz pierwszy opracowana w Japonii przez Takanashi. Odkrycia te miały zasadnicze znaczenie dla rozwoju przemysłowych procesów fermentacji stosowanych w produkcji syropu kukurydzianego o wysokiej zawartości fruktozy .
Strukturę trzeciorzędową określono dla kilku izomeraz ksylozy z drobnoustrojów począwszy od połowy lat 80. ( Streptomyces olivochromogenes w 1988 r., Streptomyces violaceoniger w 1988 r., Streptomyces rubiginosus w 1984 r., Arthrobacter B3728 w 1986 r., Actinoplanes missouriensis w 1992 r. i Clostridium thermosulfurogenes w 1990 r.).
Funkcjonować
Enzym ten uczestniczy w pentozy i glukuronianu wzajemnych i fruktozy i mannozy metabolizmu. Według International Society of Rare Sugars najbardziej biodostępnymi cukrami są: glukoza, galaktoza, mannoza, fruktoza, ksyloza, ryboza i L-arabinoza. Dwadzieścia heksoz i dziewięć pentoz, w tym ksyluloza, uznano za „rzadkie cukry”. Stąd izomeraza D-ksylozy jest wykorzystywana do produkcji tych rzadkich cukrów, które pomimo niewielkiej ilości mają bardzo ważne zastosowania w biologii.
Charakteryzacja
Izomeraza ksylozy, którą można wyizolować z czerwonego chińskiego wina ryżowego, które zawiera bakterię Lactobacillus xylosus . Bakteria ta została błędnie sklasyfikowana jako L. plantarum , która normalnie rośnie na cukrowej L-arabinozie , a rzadko rośnie na D-ksylozie. Uznano, że L. xylosus wyróżnia się zdolnością do wzrostu na D-ksylozie. Izomeraza ksylozy w L. xylosus ma masę cząsteczkową około 183000 daltonów. Jej optymalne pH wzrostu wynosi około 7,5 dla L. lactis , jednak szczepy takie jak ksyloza L. brevis preferują bardziej alkaliczne środowisko. W L. lactis szczep jest stabilny w zakresie pH od 6,5 do 11,0, a L. brevis, enzymu, który jest mniej odporny na zmiany pH, pokazują aktywność w pH w zakresie 5.7-7.0. Testy termiczne przeprowadzili również Kei Y. i Noritaka T., a izomeraza ksylozy okazała się stabilna termicznie do około 60 stopni Celsjusza
Aktywna strona i mechanizm
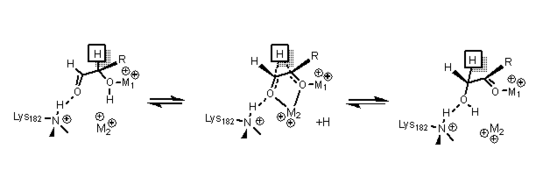
Izomeraza ksylozy ma strukturę opartą na ośmiu beczkach alfa/beta, które tworzą centrum aktywne zawierające dwa dwuwartościowe jony magnezu. Enzymy izomerazy ksylozy wykazują sfałdowanie beczkowate TIM z miejscem aktywnym w środku beczułki i tetrameryczną strukturę czwartorzędową . Struktury PDB są dostępne w linkach w infoboksie po prawej stronie. Białko jest tetramerem, w którym sparowane beczki są prawie współosiowe, tworząc dwie wnęki, w których oba metale dwuwartościowe są związane z jedną z dwóch wnęk. Metale mają geometrię oktaedryczną. Metalowe miejsce 1 wiąże mocno podłoże, podczas gdy metalowe miejsce 2 wiąże podłoże luźno. Oba mają wspólną resztę kwasową Kwas glutaminowy 216 enzymu, który łączy oba kationy. Ujemnie naładowane ligandy otaczają dwa podstawowe aminokwasy, aby je zneutralizować. Druga wnęka jest skierowana w stronę metalowej wnęki i obie wnęki mają tę samą drogę dostępu. Druga wnęka ma charakter hydrofobowy i zawiera ważną resztę histydynową, która jest aktywowana przez resztę asparaginianową związaną z nią wiązaniem wodorowym . Ta reszta histydynowa jest ważna w izomeryzacji glukozy.
W izomeryzacji glukozy histydyna 53 jest stosowana do katalizowania przeniesienia protonu O1 do O5; schemat mechanizmu otwierania pierścienia pokazano poniżej. Wspomniany wcześniej pierwszy metal koordynuje O3 i O4 i służy do dokowania podłoża.
W izomeryzacji ksylozy dane dotyczące kryształów wykazały, że cukier ksylozy wiąże się z enzymem w konformacji otwartego łańcucha . Metal 1 wiąże się z O2 i O4, a po związaniu metal 2 wiąże się z O1 i O2 w stanie przejściowym, a te interakcje wraz z resztą lizyny pomagają katalizować przesunięcie wodorkowe niezbędne do izomeryzacji. Stan przejściowy składa się z wysokoenergetycznego jonu węgla, który jest stabilizowany przez wszystkie interakcje metalu z substratem cukrowym.
Zastosowanie w przemyśle
Najszerzej stosowanym zastosowaniem tego enzymu jest konwersja glukozy do fruktozy w celu wytworzenia syropu kukurydzianego o wysokiej zawartości fruktozy (HFCS). Istnieją trzy ogólne etapy wytwarzania HFCS ze skrobi:
- enzymatyczna degradacja skrobi przy użyciu α- amylazy . Znany również jako upłynnienie.
- dalsza degradacja za pomocą glukoamylazy i enzymu usuwającego rozgałęzienia.
- Produkcja fruktozy przez izomerazę ksylozy
Proces prowadzony jest w bioreaktorach w temperaturze 60–65 °C. Enzymy ulegają dezaktywacji w takich wysokich temperaturach, a jednym z celów badań było zaprojektowanie bardziej termostabilnych wersji izomerazy ksylozy i innych enzymów w tym procesie. Enzymy są na ogół unieruchomione w celu zwiększenia wydajności; lepsze sposoby, aby to zrobić, były kolejnym przedmiotem badań.
Izomeraza ksylozy jest jednym z enzymów wykorzystywanych przez bakterie w przyrodzie do wykorzystywania celulozy jako pożywienia, a kolejny nacisk na badania przemysłowe i akademickie opracowuje wersje izomerazy ksylozy, które mogą być przydatne w produkcji biopaliw .
Jako suplement diety
Produkty zawierające izomerazę ksylozy są sprzedawane jako dostępne bez recepty suplementy diety w celu zwalczania złego wchłaniania fruktozy , głównie w Europie i pod takimi markami jak Fructaid , Fructease i Fructosin . Oprócz ogólnych obaw dotyczących skuteczności enzymów OTC, obecnie dostępne są bardzo ograniczone badania dotyczące ksylozy-izomerazy jako suplementu diety, przy czym jedyne badanie naukowe wskazuje na pozytywny wpływ na nudności i bóle brzucha związane z zespołem złego wchłaniania, ale żadne na wzdęcia .
Bibliografia
Dalsza lektura
- Hochster RM, Watson RW (1954). „Izomeryzacja enzymatyczna D-ksylozy do D-ksylulozy”. Łuk. Biochem. Biofizyka . 48 (1): 120–9. doi : 10.1016/0003-9861(54)90313-6 . PMID 13125579 .
- Ślena MW (1955). „Izomeraza ksylozy z Pasteurella pestis, szczep A-1122”. J. Am. Chem. Soc . 77 (6): 1663-1667. doi : 10.1021/ja01611a074 .
- Yamanaka K (1968). „Oczyszczanie, krystalizacja i właściwości izomerazy D-ksylozy z Lactobacillus brevis”. Biochim. Biofizyka. Akta . 151 (3): 670–80. doi : 10.1016/0005-2744(68)90015-6 . PMID 5646045 .