Ścieżka sygnalizacyjna Wnt - Wnt signaling pathway
Na szlaki do sygnalizacji Wnt to grupa sygnału transdukcji dróg, które zaczynają się od białka , które przechodzą sygnałów w komórce przez receptory na powierzchni komórek . Nazwa Wnt jest kufer stworzony z nazwami bezskrzydłe i INT-1. Ścieżki sygnałowe Wnt wykorzystują albo pobliską komunikację komórka-komórka ( parakrynna ) albo komunikację w tej samej komórce ( autokrynna ). Są wysoce konserwatywne ewolucyjnie u zwierząt, co oznacza, że są podobne we wszystkich gatunkach zwierząt, od muszek owocowych po ludzi.
Trzy ścieżki do sygnalizacji Wnt scharakteryzowano: w kanoniczną ścieżkę Wnt , w noncanonical ścieżki polaryzacji płaskiej komórek , a noncanonical szlaku WNT / wapnia . Wszystkie trzy kanały uruchamiane są przez wiązanie się z Wnt białka ligandu do Frizzled rodziny receptora , który przekazuje sygnał biologiczny do Disheveled białka wewnątrz komórki. Kanoniczny szlak Wnt prowadzi do regulacji transkrypcji genu i uważa się, że jest częściowo ujemnie regulowany przez gen SPATS1 . Niekanoniczny szlak polaryzacji komórek planarnych reguluje cytoszkielet odpowiedzialny za kształt komórki. Niekanoniczny szlak Wnt/wapń reguluje wapń wewnątrz komórki.
Sygnalizacja Wnt została najpierw zidentyfikowana ze względu na jej rolę w karcynogenezie , a następnie pod kątem jej funkcji w rozwoju embrionalnym . Procesy embrionalne, które kontroluje, obejmują kształtowanie osi ciała , specyfikację losu komórek, proliferację komórek i migrację komórek . Procesy te są niezbędne do prawidłowego tworzenia ważnych tkanek, w tym kości, serca i mięśni. Jego rolę w rozwoju embrionalnym odkryto, gdy mutacje genetyczne w białkach szlaku Wnt spowodowały powstanie nieprawidłowych zarodków muszki owocowej . Późniejsze badania wykazały, że geny odpowiedzialne za te nieprawidłowości wpłynęły również na rozwój raka piersi u myszy. Sygnalizacja Wnt kontroluje również regenerację tkanki w szpiku kostnym, skórze i jelicie dorosłych.
Kliniczne znaczenie tej ścieżki zostało wykazane przez mutacje, które prowadzą do różnych chorób, w tym raka piersi i prostaty , glejaka wielopostaciowego , cukrzycy typu II i innych. W ostatnich latach naukowcy odnotowali pierwsze udane zastosowanie inhibitorów szlaku Wnt w mysich modelach choroby.
Historia i etymologia
Na odkrycie sygnalizacji Wnt wpłynęły badania retrowirusów onkogennych (powodujących raka) . W 1982 roku Roel Nusse i Harold Varmus zainfekowali myszy wirusem mysiego nowotworu sutka w celu zmutowania mysich genów, aby zobaczyć, które zmutowane geny mogą powodować guzy piersi. Zidentyfikowali nowy protoonkogen myszy, który nazwali int1 (integracja 1).
Int1 jest wysoce konserwatywny u wielu gatunków, w tym u ludzi i Drosophila . Jego obecność w D. melanogaster doprowadziła naukowców do odkrycia w 1987 roku, że gen int1 u Drosophila był w rzeczywistości już znanym i scharakteryzowanym genem Drosophila znanym jako Wingless (Wg). Ponieważ poprzednie badania Christiane Nüsslein-Volhard i Erica Wieschhausa (które zdobyły im Nagrodę Nobla w dziedzinie fizjologii lub medycyny w 1995 roku) ustaliły już funkcję Wg jako genu polaryzacji segmentu zaangażowanego w tworzenie osi ciała podczas rozwoju embrionalnego , naukowcy ustalili, że ssaczy int1 odkryty u myszy jest również zaangażowany w rozwój embrionalny.
Dalsze badania doprowadziły do odkrycia kolejnych genów związanych z int1; jednak, ponieważ geny te nie zostały zidentyfikowane w taki sam sposób jak int1, nomenklatura genów int była niewystarczająca. W ten sposób rodzina int/Wingless stała się rodziną Wnt, a int1 — Wnt1. Nazwa Wnt jest kontaminacja int i WG i oznacza „Wingless-powiązanej miejscem integracji”.
Białka
Wnt obejmuje zróżnicowaną rodzinę glikoprotein sygnałowych o zmodyfikowanych sekrecjach lipidowych o długości 350-400 aminokwasów . Modyfikacją lipidową wszystkich Wnt jest palmitoleoilacja pojedynczej, całkowicie zakonserwowanej reszty seryny. Palmitoleoilacja jest konieczna, ponieważ jest wymagane, aby Wnt związał się z jego białkiem nośnikowym Wntless (WLS), dzięki czemu może być transportowany do błony komórkowej w celu sekrecji i umożliwia białku Wnt wiązanie się z jego receptorem. Białka Frizzled Wnt również ulegają glikozylacji , która przyłącza węglowodany w celu zapewnienia prawidłowego wydzielania. W sygnalizacji Wnt białka te działają jako ligandy aktywujące różne szlaki Wnt poprzez szlaki parakrynne i autokrynne.
Białka te są wysoce konserwatywne u różnych gatunków. Można je znaleźć u myszy, ludzi, Xenopus , danio pręgowanego , Drosophila i wielu innych.
| Gatunek | Białka Wnt |
|---|---|
| Homo sapiens | WNT1 , WNT2 , WNT2B , WNT3 , WNT3A , WNT4 , WNT5A , WNT5B , WNT6 , WNT7A , WNT7B , WNT8A , WNT8B , WNT9A , WNT9B , WNT10A , WNT10B , WNT11 , WNT16 |
| Mus musculus (Identyczne białka jak w H. sapiens) | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt9A, Wnt9B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| Xenopus | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt11R |
| Danio rerio | Wnt1, Wnt2, Wnt2B, Wnt3, Wnt3A, Wnt4, Wnt5A, Wnt5B, Wnt6, Wnt7A, Wnt7B, Wnt8A, Wnt8B, Wnt10A, Wnt10B, Wnt11, Wnt16 |
| Drosophila | DWnt2, DWnt3/5, DWnt 4, DWnt6, DWntD/DWnt8, DWnt10 |
| Hydra | hywnt1, hywnt5a, hywnt8, hywnt7, hywnt9/10a, hywnt9/10b, hywnt9/10c, hywnt11, hywnt16 |
| C. elegans | mama-2, lin-44, egl-20, cwn-1, cwn-2 |
Mechanizm

Fundacja
Sygnalizacja Wnt rozpoczyna się, gdy białko Wnt wiąże się z N-końcową zewnątrzkomórkową bogatą w cysteinę domeną receptora rodziny Frizzled (Fz). Receptory te obejmują błonę plazmatyczną siedem razy i stanowią odrębną rodzinę receptorów sprzężonych z białkiem G (GPCR). Jednakże, w celu ułatwienia sygnalizacji Wnt koreceptorów może być wymagane obok oddziaływania pomiędzy białkiem Wnt i receptora Fz. Przykłady obejmują białko związane z receptorem lipoproteinowym ( LRP )-5/6, receptorową kinazę tyrozynową (RTK) i ROR2 . Po aktywacji receptora wysyłany jest sygnał do fosfoproteiny Disheveled (Dsh), która znajduje się w cytoplazmie . Sygnał ten jest przesyłany poprzez bezpośrednią interakcję między Fz i Dsh. Białka Dsh są obecne we wszystkich organizmach i wszystkie mają następujące wysoce konserwatywne domeny białkowe : domenę DIX końca aminowego, domenę centralną PDZ i domenę DEP końca karboksylowego . Te różne domeny są ważne, ponieważ po Dsh sygnał Wnt może rozgałęziać się na wiele ścieżek, a każdy szlak oddziałuje z inną kombinacją trzech domen.
Ścieżki kanoniczne i niekanoniczne
Trzy najlepiej scharakteryzowane szlaki sygnałowe Wnt to kanoniczny szlak Wnt, niekanoniczny szlak polaryzacji komórek planarnych i niekanoniczny szlak Wnt/wapń. Jak sugerują ich nazwy, ścieżki te należą do jednej z dwóch kategorii: kanonicznej lub niekanonicznej. Różnica między kategoriami polega na tym, że szlak kanoniczny obejmuje białko β- kateninę, podczas gdy szlak niekanoniczny działa niezależnie od niego.
Ścieżka kanoniczna
Kanoniczna Wnt ścieżka (lub szlaku WNT / β-kateniny szlaku) jest ścieżką Wnt, która powoduje gromadzenie się kateniny w cytoplazmie i jego ewentualnego przemieszczania się do jądra w celu działania jako transkrypcyjny koaktywatorem na czynniki transkrypcyjne , które należą do TCF / Rodzina LEF . Bez Wnt β-katenina nie gromadziłaby się w cytoplazmie, ponieważ kompleks destrukcyjny normalnie by ją degradował. Ten kompleks destrukcyjny obejmuje następujące białka: Aksynę , polipowatość gruczolakowatości jelita grubego (APC), fosfatazę białkową 2A (PP2A), kinazę syntazy glikogenu 3 (GSK3) i kinazę kazeinową 1α (CK1α). Rozkłada β-kateninę, kierując ją do ubikwitynacji , która następnie wysyła ją do proteasomu w celu strawienia. Jednakże, gdy tylko Wnt zwiąże Fz i LRP5 / 6 , funkcja kompleksu niszczenia zostaje zakłócona. Wynika to z tego, że Wnt powoduje translokację negatywnego regulatora Wnt, Aksyny, i kompleksu destrukcyjnego do błony plazmatycznej. Fosforylacja przez inne białka w kompleksie niszczącym wiąże następnie Aksynę z ogonem cytoplazmatycznym LRP5/6. Aksyna ulega defosforylacji, a jej stabilność i poziomy spadają. Dsh zostaje następnie aktywowany poprzez fosforylację, a jego domeny DIX i PDZ hamują aktywność GSK3 kompleksu destrukcyjnego. Umożliwia to akumulację i lokalizację β-kateniny w jądrze, a następnie indukowanie odpowiedzi komórkowej poprzez transdukcję genów wraz z czynnikami transkrypcyjnymi TCF/LEF (czynnik komórek T/czynnik wzmacniający limfoidy). β-katenina rekrutuje inne koaktywatory transkrypcji, takie jak BCL9 , Pygopus i Parafibromin/Hyrax. Złożoność kompleksu transkrypcyjnego złożonego przez β-kateninę zaczyna się ujawniać dzięki nowym, wysokoprzepustowym badaniom proteomicznym . Jednak wciąż brakuje ujednoliconej teorii, w jaki sposób β-katenina kieruje ekspresją docelowych genów, a gracze specyficzni tkankowo mogą pomóc β-kateninie w zdefiniowaniu jej docelowych genów. Extensivity z kateniny oddziałujących białek komplikuje rozumienie: β-kateniny, może być bezpośrednio na Ser552 fosforylacji Akt, przez co powoduje jej do rozłączenia z kontaktów komórka-komórka i akumulacji w cytozolu, następnie 14-3-3ζ współdziała z kateniny (pSer552) i wzmacnia jego translokację jądrową. Doniesiono, że BCL9 i Pygopus w rzeczywistości posiadają kilka funkcji niezależnych od β-kateniny (dlatego prawdopodobnie niezależne od sygnalizacji Wnt).
Ścieżki niekanoniczne
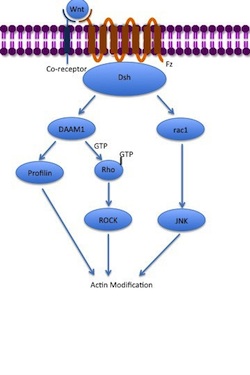
Szlak niekanonicznej polaryzacji komórek planarnych (PCP) nie obejmuje β-kateniny. Nie wykorzystuje LRP-5/6 jako współreceptora i uważa się, że wykorzystuje NRH1 , Ryk , PTK7 lub ROR2 . Szlak PCP jest aktywowany przez wiązanie Wnt z Fz i jego koreceptorem. Receptor następnie rekrutuje Dsh , który wykorzystuje swoje domeny PDZ i DIX do utworzenia kompleksu z aktywatorem morfogenezy 1 związanym z Dishevelled ( DAAM1 ). Daam1 następnie aktywuje małe białko G Rho poprzez czynnik wymiany guaniny . Rho aktywuje kinazę związaną z Rho (ROCK), która jest jednym z głównych regulatorów cytoszkieletu . Dsh tworzy również kompleks z rac1 i pośredniczy w wiązaniu profiliny z aktyną . Rac1 aktywuje JNK i może również prowadzić do polimeryzacji aktyny . Wiązanie profiliny z aktyną może prowadzić do przebudowy cytoszkieletu i gastrulacji .
Niekanoniczny szlak Wnt/wapń również nie obejmuje β-kateniny. Jego rolą jest pomoc w regulacji uwalniania wapnia z retikulum endoplazmatycznego (ER) w celu kontrolowania wewnątrzkomórkowego poziomu wapnia. Podobnie jak inne szlaki Wnt, po związaniu liganda aktywowany receptor Fz bezpośrednio oddziałuje z Dsh i aktywuje specyficzne domeny białka Dsh. Domeny zaangażowane w sygnalizację Wnt/wapń to domeny PDZ i DEP. Jednak w przeciwieństwie do innych szlaków Wnt, receptor Fz łączy się bezpośrednio z trimerycznym białkiem G. Ta kostymulacja Dsh i białka G może prowadzić do aktywacji PDE specyficznych dla PLC lub cGMP . Jeśli PLC jest aktywowany, składnik błony plazmatycznej PIP2 jest rozszczepiany na DAG i IP3 . Kiedy IP3 wiąże swój receptor na ER, uwalniany jest wapń. Zwiększone stężenia wapnia i DAG mogą aktywować Cdc42 poprzez PKC . Cdc42 jest ważnym regulatorem wzorców brzusznych. Zwiększony poziom wapnia aktywuje również kalcyneurynę i CaMKII . CaMKII indukuje aktywację czynnika transkrypcyjnego NFAT , który reguluje adhezję komórek, migrację i separację tkanek. Kalcyneuryna aktywuje kinazę TAK1 i NLK , które mogą zakłócać sygnalizację TCF/β-katenina w kanonicznym szlaku Wnt. Jednakże, jeśli PDE jest aktywowany, uwalnianie wapnia z ER jest hamowane. PDE pośredniczy w tym poprzez hamowanie PKG, co z kolei powoduje zahamowanie uwalniania wapnia.
Zintegrowana ścieżka Wnt
Analizowano binarne rozróżnienie kanonicznych i niekanonicznych szlaków sygnalizacyjnych Wnt i zaproponowano zintegrowany, zbieżny szlak Wnt. Pewne dowody na to znaleziono dla jednego liganda Wnt (Wnt5A). Dowody na zbieżny szlak sygnalizacji Wnt, który wykazuje zintegrowaną aktywację sygnalizacji Wnt/Ca2+ i Wnt/β-katenina, dla wielu ligandów Wnt, zostały opisane w liniach komórkowych ssaków.
Inne ścieżki
Sygnalizacja Wnt reguluje również szereg innych szlaków sygnałowych, które nie zostały tak dokładnie wyjaśnione. Jeden z takich szlaków obejmuje interakcję między Wnt i GSK3. Podczas wzrostu komórek Wnt może hamować GSK3 w celu aktywacji mTOR przy braku β-kateniny. Jednak Wnt może również służyć jako negatywny regulator mTOR poprzez aktywację supresora guza TSC2 , który jest regulowany w górę przez oddziaływanie Dsh i GSK3. Podczas miogenezy , Wnt wykorzystuje PA i CREB aby aktywować MyoD i Myf5 genów. Wnt działa również w połączeniu z Rykiem i Src, aby umożliwić regulację odpychania neuronów podczas prowadzenia aksonów . Wnt reguluje gastrulację, gdy CK1 służy jako inhibitor Rap1-ATPazy w celu modulowania cytoszkieletu podczas gastrulacji. Dalszą regulację gastrulacji osiąga się, gdy Wnt wykorzystuje ROR2 wraz ze szlakiem CDC42 i JNK do regulacji ekspresji PAPC . Dsh może również oddziaływać z aPKC, Pa3 , Par6 i LG1 w celu kontrolowania polarności komórek i rozwoju cytoszkieletu mikrotubul . Chociaż szlaki te nakładają się na elementy związane z sygnalizacją PCP i Wnt/Wapń, uważa się je za odrębne szlaki, ponieważ wywołują różne odpowiedzi.
Rozporządzenie
Aby zapewnić prawidłowe funkcjonowanie, sygnalizacja Wnt jest stale regulowana w kilku punktach wzdłuż jej szlaków sygnalizacyjnych. Na przykład białka Wnt są palmitoilowane . Białko jeżozwierza pośredniczy w tym procesie, co oznacza, że pomaga regulować wydzielanie ligandu Wnt, określając, kiedy jest on w pełni uformowany. Wydzielanie jest dalej kontrolowane za pomocą białek, takich jak GPR177 (bez własności) i równomierności przerwanej oraz kompleksów, takich jak kompleks retromerowy .
Po sekrecji ligandowi można uniemożliwić dotarcie do jego receptora poprzez wiązanie białek, takich jak stabilizatory Dally i glipikan 3 (GPC3), które hamują dyfuzję. W komórkach nowotworowych zarówno łańcuchy siarczanu heparanu, jak i białko rdzeniowe GPC3 są zaangażowane w regulację wiązania Wnt i aktywację proliferacji komórek. Wnt rozpoznaje strukturę siarczanu heparanu na GPC3, która zawiera IdoA2S i GlcNS6S, a 3-O-siarczanowanie w GlcNS6S3S zwiększa wiązanie Wnt z glipikanem siarczanu heparanu. Zidentyfikowano bogatą w cysteinę domenę w płacie N GPC3, tworzącą hydrofobową bruzdę wiążącą Wnt, zawierającą fenyloalaninę-41, która oddziałuje z Wnt. Blokowanie domeny wiążącej Wnt przy użyciu nanociała zwanego HN3 może hamować aktywację Wnt.
Na receptorze Fz wiązanie białek innych niż Wnt może antagonizować sygnalizację. Konkretni antagoniści obejmują Dickkopf (Dkk), czynnik hamujący Wnt 1 (WIF-1), sekrecyjne białka związane z Frizzled (SFRP), Cerberus , Frzb , Wise , SOST i naskórek . Stanowią one inhibitory sygnalizacji Wnt. Jednak inne cząsteczki również działają jako aktywatory. Norryna i R-Spondin2 aktywują sygnalizację Wnt pod nieobecność liganda Wnt.
Interakcje między szlakami sygnalizacyjnymi Wnt regulują również sygnalizację Wnt. Jak wspomniano wcześniej, szlak Wnt/wapń może hamować TCF/β-katenina, zapobiegając kanonicznej sygnalizacji szlaku Wnt. Prostaglandyna E2 jest niezbędnym aktywatorem kanonicznego szlaku sygnałowego Wnt. Oddziaływanie PGE2 z jego receptorami E2/E4 stabilizuje β-kateninę poprzez fosforylację za pośrednictwem cAMP/PKA. Synteza PGE2 jest niezbędna do procesów, w których pośredniczy sygnalizacja Wnt, takich jak regeneracja tkanek i kontrola populacji komórek macierzystych u danio pręgowanego i myszy. Co ciekawe, nieustrukturyzowane regiony kilku przerośniętych wewnętrznie nieuporządkowanych białek odgrywają kluczową rolę w regulacji sygnalizacji Wnt.
Indukowane odpowiedzi komórek
Rozwój zarodkowy
Sygnalizacja Wnt odgrywa kluczową rolę w rozwoju embrionalnym. Działa zarówno u kręgowców, jak i bezkręgowców , w tym ludzi, żab, danio pręgowanego, C. elegans , Drosophila i innych. Po raz pierwszy znaleziono go w biegunowości segmentu Drosophila, gdzie pomaga ustalić biegunowość przednią i tylną. Jest zaangażowany w inne procesy rozwojowe . Jak sugeruje jego funkcja u Drosophila , odgrywa kluczową rolę w tworzeniu osi ciała , szczególnie w tworzeniu osi przednio - tylnej i grzbietowo - brzusznej . Bierze udział w indukcji różnicowania komórek w celu szybkiego tworzenia ważnych narządów, takich jak płuca i jajniki . Wnt dodatkowo zapewnia rozwój tych tkanek poprzez odpowiednią regulację proliferacji i migracji komórek . Funkcje sygnalizacji Wnt można podzielić na układanie osi, specyfikację losu komórek, proliferację komórek i migrację komórek.
Wzór osi
We wczesnym rozwoju embrionalnym, tworzenie głównych osi ciała jest kluczowym krokiem w ustalaniu ogólnego planu budowy ciała. Osie obejmują oś przednio-tylną, oś grzbietowo-brzuszną i oś prawo-lewo. Sygnalizacja Wnt bierze udział w tworzeniu osi przednio-tylnej i grzbietowo-brzusznej (DV). Aktywność sygnalizacyjną Wnt w rozwoju przednio-tylnym można zaobserwować u ssaków, ryb i żab. U ssaków prymitywne prążki i inne otaczające tkanki wytwarzają związki morfogeniczne Wnts, BMP , FGF , Nodal i kwas retinowy, aby ustalić obszar tylny podczas późnej gastruli . Białka te tworzą gradienty stężeń. Obszary o najwyższym stężeniu wyznaczają obszar tylny, podczas gdy obszary o najniższym stężeniu wskazują obszar przedni. U ryb i żab β-katenina wytwarzana przez kanoniczną sygnalizację Wnt powoduje tworzenie się centrów organizujących, które wraz z BMP wywołują formację tylną. Zaangażowanie Wnt w tworzenie osi DV widać w działalności formacji organizatora Spemanna , który ustanawia obszar grzbietowy. Kanoniczna sygnalizacja Wnt Produkcja β-kateniny indukuje tworzenie tego organizatora poprzez aktywację genów bliźniąt i siamois. Podobnie w ptasiej gastrulacji, komórki sierpa Kollera wyrażają różne geny markerowe mezodermy, które umożliwiają zróżnicowany ruch komórek podczas formowania prymitywnej smugi. Za ten ruch odpowiada sygnalizacja Wnt aktywowana przez FGF.
Sygnalizacja Wnt bierze również udział w tworzeniu osi określonych części ciała i późniejszych układów narządów. U kręgowców gradienty sygnalizacji morfogenetycznej Sonic hedgehog (Shh) i Wnt ustalają oś grzbietowo-brzuszną ośrodkowego układu nerwowego podczas osiowego wzorcowania cewy nerwowej . Wysoka sygnalizacja Wnt ustanawia obszar grzbietowy, podczas gdy wysoka sygnalizacja Shh wskazuje obszar brzuszny. Wnt bierze udział w tworzeniu DV ośrodkowego układu nerwowego poprzez swoje zaangażowanie w kierowanie aksonami . Białka Wnt prowadzą aksony rdzenia kręgowego w kierunku przednio-tylnym. Wnt bierze również udział w tworzeniu osi DV kończyny. W szczególności Wnt7a pomaga wytworzyć wzór grzbietowy rozwijającej się kończyny.
W embrionalnych falach różnicowania model rozwoju Wnt odgrywa kluczową rolę jako część kompleksu sygnalizacyjnego w kompetentnych komórkach gotowych do różnicowania. Wnt reaguje na aktywność cytoszkieletu, stabilizując początkową zmianę wytworzoną przez przechodzącą falę skurczu lub ekspansji i jednocześnie sygnalizuje jądru poprzez wykorzystanie różnych ścieżek sygnałowych, w której fali brała udział dana komórka. sygnalizacja mechaniczna występująca podczas rozwoju.
Specyfikacja losu komórki
Specyfikowanie losu komórki lub różnicowanie komórek to proces, w którym niezróżnicowane komórki mogą stać się bardziej wyspecjalizowanym typem komórek. Sygnalizacji Wnt indukuje różnicowanie pluripotencjalnych komórek macierzystych do mezodermy i endodermy komórek progenitorowych . Te komórki progenitorowe dalej różnicują się w typy komórek, takie jak linie mięśni gładkich śródbłonka, serca i naczyń. Sygnalizacja Wnt indukuje tworzenie krwi z komórek macierzystych. W szczególności Wnt3 prowadzi do komórek zaangażowanych w mezodermę o potencjale krwiotwórczym . Wnt1 antagonizuje różnicowanie neuronalne i jest głównym czynnikiem samoodnowy nerwowych komórek macierzystych. Pozwala to na regenerację komórek układu nerwowego, co jest kolejnym dowodem na rolę w promowaniu proliferacji nerwowych komórek macierzystych. Sygnalizacja Wnt bierze udział w określaniu komórek rozrodczych , specyfikacji tkanki jelitowej , rozwoju mieszków włosowych, rozwoju tkanki płucnej, różnicowaniu komórek grzebienia nerwowego tułowia , rozwoju nefronów, rozwoju jajników i określaniu płci . Sygnalizacja Wnt również antagonizuje tworzenie się serca, a hamowanie Wnt okazało się krytycznym induktorem tkanki serca podczas rozwoju, a drobnocząsteczkowe inhibitory Wnt są rutynowo stosowane do wytwarzania kardiomiocytów z pluripotencjalnych komórek macierzystych.
Proliferacja komórek
Aby uzyskać masowe zróżnicowanie komórek potrzebnych do utworzenia określonych tkanek komórkowych różnych organizmów, musi nastąpić proliferacja i wzrost embrionalnych komórek macierzystych . W procesie tym pośredniczy kanoniczna sygnalizacja Wnt, która zwiększa jądrową i cytoplazmatyczną β-kateninę. Zwiększona β-katenina może inicjować transkrypcyjną aktywację białek, takich jak cyklina D1 i c-myc , które kontrolują przejście z fazy G1 do S w cyklu komórkowym . Wejście w fazę S powoduje replikację DNA i ostatecznie mitozę , które są odpowiedzialne za proliferację komórek. Ten wzrost proliferacji jest bezpośrednio powiązany z różnicowaniem komórek, ponieważ w miarę proliferacji komórki macierzyste również się różnicują. Pozwala to na ogólny wzrost i rozwój określonych układów tkankowych podczas rozwoju embrionalnego. Jest to widoczne w układach takich jak układ krążenia, gdzie Wnt3a prowadzi do proliferacji i ekspansji krwiotwórczych komórek macierzystych potrzebnych do tworzenia czerwonych krwinek.
Biochemia nowotworowych komórek macierzystych różni się nieznacznie od innych komórek nowotworowych. Te tak zwane komórki uzależnione od Wnt przejmują kontrolę i zależą od ciągłej stymulacji szlaku Wnt, aby promować ich niekontrolowany wzrost, przeżycie i migrację. W przypadku raka , sygnalizacja Wnt może stać się niezależna od regularnych bodźców, poprzez mutacje w dalszych onkogenach i genach supresorowych guza, które stają się trwale aktywowane, nawet jeśli normalny receptor nie otrzymał sygnału. β-katenina wiąże się z czynnikami transkrypcyjnymi, takimi jak białko TCF4 iw połączeniu te cząsteczki aktywują niezbędne geny. LF3 silnie hamuje to wiązanie in vitro, w liniach komórkowych i zmniejsza wzrost guza w modelach mysich. Zapobiegał replikacji i zmniejszał ich zdolność do migracji, a wszystko to bez wpływu na zdrowe komórki. Po leczeniu nie pozostały żadne komórki macierzyste raka. Odkrycie było wynikiem „ racjonalnego projektowania leków ”, z wykorzystaniem technologii AlphaScreens i ELISA.
Migracja komórek
Migracja komórek podczas rozwoju embrionalnego pozwala na ustalenie osi ciała, tworzenie tkanek, indukcję kończyn i kilka innych procesów. Sygnalizacja Wnt pomaga pośredniczyć w tym procesie, szczególnie podczas zbieżnego rozszerzania. Sygnalizacja zarówno ze szlaku Wnt PCP, jak i kanonicznego szlaku Wnt jest wymagana do prawidłowego zbieżnego wydłużenia podczas gastrulacji. Zbieżne wydłużenie jest dalej regulowane przez szlak Wnt/wapń, który po aktywacji blokuje zbieżne wydłużenie. Sygnalizacja Wnt indukuje również migrację komórek w późniejszych stadiach rozwoju poprzez kontrolę zachowania migracyjnego neuroblastów , komórek grzebienia nerwowego , miocytów i komórek tchawicy.
Sygnalizacja Wnt jest zaangażowana w inny kluczowy proces migracji znany jako przejście nabłonkowo-mezenchymalne (EMT). Proces ten umożliwia komórkom nabłonkowym przekształcenie się w komórki mezenchymalne, dzięki czemu nie są one dłużej utrzymywane w lamininie . Obejmuje regulację w dół kadheryny, dzięki czemu komórki mogą odłączyć się od lamininy i migrować. Sygnalizacja Wnt jest induktorem EMT, szczególnie w rozwoju sutka.
Wrażliwość na insulinę
Insulina jest hormonem peptydowym zaangażowanym w homeostazę glukozy w niektórych organizmach. W szczególności prowadzi to do regulacji w górę transporterów glukozy w błonie komórkowej w celu zwiększenia wychwytu glukozy z krwiobiegu . W procesie tym częściowo pośredniczy aktywacja sygnalizacji Wnt/β-katenina, która może zwiększyć wrażliwość komórki na insulinę. W szczególności Wnt10b jest białkiem Wnt, które zwiększa tę wrażliwość w komórkach mięśni szkieletowych.
Implikacje kliniczne
Nowotwór
Od czasu pierwszego odkrycia sygnalizacja Wnt ma związek z rakiem . Kiedy odkryto Wnt1, po raz pierwszy zidentyfikowano go jako protoonkogen w mysim modelu raka piersi. Fakt, że Wnt1 jest homologiem Wg, pokazuje, że bierze udział w rozwoju embrionalnym, co często wymaga szybkiego podziału i migracji komórek. Nieprawidłowa regulacja tych procesów może prowadzić do rozwoju nowotworu poprzez nadmierną proliferację komórek.
Aktywność kanonicznego szlaku Wnt bierze udział w rozwoju łagodnych i złośliwych guzów piersi. Dobrze udokumentowana została również rola szlaku Wnt w chemooporności nowotworu, jak również jego rola w utrzymywaniu odrębnej subpopulacji komórek inicjujących nowotwór. O jej obecności świadczy podwyższony poziom β-kateniny w jądrze i/lub cytoplazmie, co można wykryć za pomocą barwienia immunohistochemicznego i Western blotting . Zwiększona ekspresja β-kateniny jest skorelowana ze złym rokowaniem u chorych na raka piersi. Ta akumulacja może być spowodowana takimi czynnikami, jak mutacje w β-kateninie, niedobory kompleksu niszczenia β-kateniny, najczęściej mutacje w strukturalnie nieuporządkowanych regionach APC , nadekspresja ligandów Wnt, utrata inhibitorów i/lub zmniejszona aktywność regulatorów szlaki (takie jak szlak Wnt/wapń). Guzy piersi mogą dawać przerzuty z powodu zaangażowania Wnt w EMT. Badania dotyczące przerzutów podstawnopodobnego raka piersi do płuc wykazały, że tłumienie sygnalizacji Wnt/β-katenina może zapobiegać EMT, co może hamować przerzuty.
Sygnalizacja Wnt jest zaangażowana w rozwój innych nowotworów. Zmiany w ekspresji CTNNB1 , czyli genu kodującego β-kateninę, można mierzyć w nowotworach piersi, jelita grubego , czerniaku , prostacie , płucach i innych. Zwiększoną ekspresję białek ligandu Wnt, takich jak Wnt1, Wnt2 i Wnt7A, zaobserwowano odpowiednio w rozwoju glejaka wielopostaciowego , raka przełyku i raka jajnika . Inne białka, które powodują wiele typów raka przy braku prawidłowego funkcjonowania, obejmują ROR1, ROR2, SFRP4 , Wnt5A, WIF1 i te z rodziny TCF/LEF.
Związek między PGE2 i Wnt sugeruje, że przewlekły wzrost PGE2 związany ze stanem zapalnym może prowadzić do aktywacji szlaku Wnt w różnych tkankach, powodując karcynogenezę .
Cukrzyca typu II
Cukrzyca typu 2 jest częstą chorobą, która powoduje zmniejszone wydzielanie insuliny i zwiększoną insulinooporność na obwodzie. Powoduje to podwyższony poziom glukozy we krwi lub hiperglikemię , co może być śmiertelne, jeśli nie jest leczone. Ponieważ sygnalizacja Wnt jest zaangażowana we wrażliwość na insulinę, może być zaangażowane nieprawidłowe działanie jej szlaku. Na przykład nadekspresja Wnt5b może zwiększać podatność ze względu na jego rolę w adipogenezie , ponieważ otyłość i cukrzyca typu II mają wysoką współwystępowanie . Sygnalizacja Wnt jest silnym aktywatorem biogenezy mitochondriów . Prowadzi to do zwiększonej produkcji reaktywnych form tlenu (ROS), o których wiadomo, że powodują uszkodzenia DNA i komórek. To uszkodzenie wywołane przez ROS jest znaczące, ponieważ może powodować ostrą insulinooporność wątroby lub insulinooporność wywołaną urazem. Mutacje w czynnikach transkrypcyjnych związanych z sygnalizacją Wnt, takich jak TCF7L2 , są powiązane ze zwiększoną podatnością.
Zobacz też
- AXIN1
- GSK-3
- Zarządzanie wypadaniem włosów
- Bezskrzydły element lokalizacyjny 3 (WLE3)
- Białko szlaku sygnałowego 1 indukowanej WNT1 (WISP1)
- Białko szlaku sygnalizacyjnego 2 indukowalnego WNT1 (WISP2)
- Białko szlaku sygnalizacyjnego 3 indukowalnego WNT1 (WISP3)
Bibliografia
Dalsza lektura
- Miloszevicia V, et al. (styczeń 2020). „Obwody autokrynne Wnt/IL-1β/IL-8 kontrolują chemooporność w komórkach inicjujących międzybłoniaka poprzez indukcję ABCB5” . wewn. J. Rak . 146 (1): 192-207. doi : 10.1002/ijc.32419 . PMID 31107974 . S2CID 160014053 .
- Dinasarapu AR, Saunders B, Ozerlat I, Azam K, Subramaniam S (czerwiec 2011). "Sygnalizacyjne strony cząsteczek bramy - perspektywa modelu danych" . Bioinformatyka . 27 (12): 1736–8. doi : 10.1093/bioinformatyka/btr190 . PMC 3106186 . PMID 21505029 .
Zewnętrzne linki
- Wnt+Białka w amerykańskiej National Library of Medicine Medical Subject Headings (MeSH)