Troponina I - Troponin I
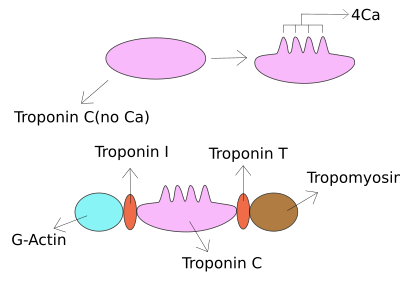
Troponina I należy do rodziny białek serca i mięśni szkieletowych . Jest częścią kompleksu białek troponiny , gdzie wiąże się z aktyną w cienkich miofilamentach, aby utrzymać kompleks aktyna-tropomiozyna na miejscu. Troponina I zapobiega wiązaniu miozyny z aktyną w rozluźnionych mięśniach. Kiedy wapń wiąże się z troponiną C, powoduje zmiany konformacyjne, które prowadzą do przemieszczenia troponiny I. Następnie tropomiozyna opuszcza miejsce wiązania miozyny na aktynie, co prowadzi do skurczu mięśni. Litera I nadana jest ze względu na jej hamujący charakter. Jest przydatnym markerem w laboratoryjnej diagnostyce zawału serca. Występuje przy innym stężeniu w osoczu, ale w tych samych okolicznościach co troponina T - każdy test można przeprowadzić w celu potwierdzenia uszkodzenia mięśnia sercowego, a laboratoria zwykle oferują jeden lub drugi test.
Trzy paralogi z unikalnymi wzorcami ekspresji specyficznymi dla tkanki są wyrażane u ludzi, wymienione poniżej z ich lokalizacjami i dostępami do OMIM :
- Wolnokurczliwa izoforma mięśni szkieletowych - troponina I, TNNI1 (1q31.3, 191042 )
- Szybkokurczliwa izoforma mięśni szkieletowych, troponina I, TNNI2 (11p15.5, 191043 )
- Sercowa troponina I, TNNI3 (19q13.4, 191044 )
cTnI
Sercowa troponina I, często określana jako cTnI, jest prezentowana w tkance mięśnia sercowego przez pojedynczą izoformę o masie cząsteczkowej 23,9 kDa. Składa się z 209 reszt aminokwasowych. Teoretyczny pI cTnI wynosi 9,05. cTnI różni się od innych troponin swoim N-końcowym wydłużeniem o 26 aminokwasów. To rozszerzenie zawiera dwie seryny, reszty 23 i 24, które są fosforylowane przez kinazę białkową A w odpowiedzi na stymulację beta-adrenergiczną i są ważne w zwiększaniu odpowiedzi inotropowej. Fosforylacja cTnI zmienia konformację białka i modyfikuje jego interakcję z innymi troponinami, a także z przeciwciałami anty-TnI. Zmiany te zmieniają odpowiedź miofilamentów na wapń i są interesujące w zwalczaniu niewydolności serca. Monitorowanie wielokrotnych reakcji ludzkiego cTnI ujawniło, że istnieje 14 miejsc fosforylacji, a obserwowany wzór fosforylacji zmienia się w odpowiedzi na chorobę. Wykazano, że cTnI jest fosforylowana przez kinazę białkową A, kinazę białkową C , kinazę białkową G i kinazę 3 aktywowaną p21 . Znaczna część cTnI uwalniana do krwiobiegu pacjenta ulega fosforylacji. Od ponad 15 lat cTnI jest znany jako wiarygodny marker uszkodzenia tkanki mięśnia sercowego. Uważa się, że jest bardziej czuły i znacznie bardziej swoisty w diagnostyce zawału mięśnia sercowego niż „złoty marker ” ostatnich dziesięcioleci - CK-MB , a także całkowita kinaza kreatynowa , mioglobina i izoenzymy dehydrogenazy mleczanowej .
Troponina I nie jest całkowicie specyficzna dla uszkodzenia mięśnia sercowego wtórnego do zawału. Inne przyczyny podwyższonej troponiny I obejmują przewlekłą niewydolność nerek , niewydolność serca , krwotok podpajęczynówkowy i zator płucny .
W medycynie weterynaryjnej zaobserwowano zwiększone stężenie cTnI w wyniku uszkodzenia mięśnia sercowego po toksyczności jonoforu u bydła.
Zobacz też
Linki zewnętrzne
- Troponina + I w US National Library of Medicine Medical Subject Headings (MeSH)