Fluorek cyny(II) - Tin(II) fluoride
Sn 2+ ; F −
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Fluorek cyny(II)
|
|
| Inne nazwy
Fluorek cynawy
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| Karta informacyjna ECHA |
100.029.090 |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS | |
| UNII | |
| Numer ONZ | 3288 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| SnF 2 | |
| Masa cząsteczkowa | 156,69 g/mol |
| Wygląd zewnętrzny | bezbarwne ciało stałe |
| Gęstość | 4,57 g / cm 3 |
| Temperatura topnienia | 213 ° C (415 ° F; 486 K) |
| Temperatura wrzenia | 850 ° C (1560 ° F; 1120 K) |
| 31 g/100 ml (0°C); 35 g/100 ml (20°C); 78,5 g.100 ml (106 °C) |
|
| Rozpuszczalność | rozpuszczalny w KOH , KF ; znikome w etanolu , eterze , chloroformie |
| Struktura | |
| Jednoskośny , mS48 | |
| C2/c, nr 15 | |
| Farmakologia | |
| A01AA04 ( KTO ) | |
| Zagrożenia | |
| Arkusz danych dotyczących bezpieczeństwa | ICSC 0860 |
| NFPA 704 (ognisty diament) | |
| Temperatura zapłonu | Nie palne |
| Związki pokrewne | |
|
Inne aniony
|
Chlorek cyny (II) , cyny (II), bromek , cyna (II), jodek |
|
Inne kationy
|
Tetrafluorek germanu , cyny, tetrafluorek , ołowiu (II), fluorek |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Cyny (II), fluorek , powszechnie nazywane handlowo fluorek cyny (od łacińskiego Stannum „puszka”) jest związek chemiczny o wzorze SNF 2 . Jest to bezbarwna substancja stała stosowana jako składnik past do zębów .
Korzyści dla zdrowia jamy ustnej
Fluorek cynawy został wprowadzony jako alternatywa dla fluorku sodu w zapobieganiu próchnicy zębów . Wprowadzili go w tym celu Joseph Muhler i William Nebergall. W uznaniu za ich innowacyjność, te dwie osoby zostały wprowadzone do Galerii Sław Wynalazcy.
Fluor zawarty w fluorku cynawym pomaga w przemianie apatytu wapnia w zębach w fluoroapatyt , co sprawia, że szkliwo zębów jest bardziej odporne na ataki kwasów wytwarzanych przez bakterie . Wapń obecny w płytce nazębnej i ślinie reaguje z fluorem, tworząc fluorek wapnia na powierzchni zęba; z biegiem czasu ten fluorek wapnia rozpuszcza się, umożliwiając interakcję jonów wapnia i fluoru z zębem i tworzenie apatytu zawierającego fluor w strukturze zęba. Ta reakcja chemiczna hamuje demineralizację i może sprzyjać remineralizacji próchnicy. Powstały apatyt zawierający fluor jest bardziej nierozpuszczalny i bardziej odporny na działanie kwasów i próchnicy zębów.
Oprócz fluoru jony cynawe są korzystne dla zdrowia jamy ustnej, gdy są zawarte w paście do zębów. Wykazano, że przy podobnych stężeniach fluoru pasty do zębów zawierające fluorek cynawy są bardziej skuteczne niż pasty zawierające fluorek sodu w zmniejszaniu częstości występowania próchnicy i erozji zębów , a także w zmniejszaniu zapalenia dziąseł . Niektóre pasty do zębów zawierające fluorek cynawy zawierają również składniki, które umożliwiają lepsze usuwanie przebarwień. Stabilizowane preparaty z fluorkiem cynawym pozwalają na większą biodostępność jonów cynawych i fluorkowych, zwiększając ich korzyści dla zdrowia jamy ustnej. Przegląd systematyczny wykazał, że stabilizowane pasty do zębów zawierające fluorek cynawy miały pozytywny wpływ na redukcję płytki nazębnej , zapalenia dziąseł i przebarwień, ze znaczącym zmniejszeniem kamienia nazębnego i nieświeżego oddechu (nieświeżego oddechu) w porównaniu z innymi pastami do zębów. Specyficzna formuła stabilizowanych past do zębów z fluorkiem cynawym wykazała lepszą ochronę przed erozją zębów i nadwrażliwością zębiny w porównaniu z innymi pastami do zębów zawierającymi fluor i niezawierającymi fluoru.
Fluorek cynawy był kiedyś używany pod nazwą handlową Fluoristan w oryginalnym składzie pasty do zębów marki Crest , chociaż później został zastąpiony monofluorofosforanem sodu pod nazwą handlową Fluoristat. Stabilizowany fluorek cynawy jest obecnie aktywnym składnikiem pasty do zębów marki Crest/Oral B Pro-Health. Chociaż wcześniej podnoszono obawy, że fluorek cynawy może powodować przebarwienia zębów, można tego uniknąć poprzez odpowiednie szczotkowanie i stosowanie stabilizowanej pasty do zębów z fluorkiem cynawym. Wszelkie przebarwienia fluorkiem cynawym, które powstają w wyniku niewłaściwego szczotkowania, nie są trwałe, a Crest/Oral B Pro-Health twierdzi, że jego konkretna formuła jest odporna na przebarwienia.
Produkcja
SnF 2 można otrzymać przez odparowanie roztworu SnO w 40% HF .
- SnO + 2 HF → SnF 2 + H 2 O
Roztwory wodne
Łatwo rozpuszczalny w wodzie, SnF 2 jest hydrolizowany. W niskim stężeniu tworzy takie związki jak SnOH + , Sn(OH) 2 i Sn(OH) 3 − . W wyższych stężeniach powstają głównie gatunki wielopierścieniowe, w tym Sn 2 (OH) 2 2+ i Sn 3 (OH) 4 2+ . Roztwory wodne łatwo utleniają się, tworząc nierozpuszczalne osady Sn IV , które są nieskuteczne w profilaktyce stomatologicznej. Badania utleniania za pomocą spektroskopii Mössbauera na zamrożonych próbkach sugerują, że O 2 jest indywiduum utleniającym.
Kwasowość Lewisa
SnF 2 działa jak kwas Lewisa . Na przykład tworzy kompleks 1:1 (CH 3 ) 3 NSnF 2 i 2:1 [(CH 3 ) 3 N] 2 SnF 2 z trimetyloaminą oraz kompleks 1:1 z dimetylosulfotlenkiem , (CH 3 ) 2 SO·SnF 2 .
W roztworach zawierających jon fluorkowy F − , tworzy kompleksy fluorkowe SnF 3 − , Sn 2 F 5 − i SnF 2 (OH 2 ). Krystalizacja z wodnego roztworu zawierającego NaF daje związki zawierające aniony wielopierścieniowe, np. NaSn 2 F 5 lub Na 4 Sn 3 F 10 w zależności od warunków reakcji, a nie NaSnF 3 . Związek NaSnF 3 , zawierającą piramidy SNF 3 - anion można wytworzyć z roztworu pirydyny i wody. Znane są inne związki zawierające piramidalny anion SnF 3 − , takie jak Ca(SnF
3)
2.
Właściwości redukujące
SNF 2 jest środkiem redukującym , a standardowym potencjale redukcyjnym E ° (Sn IV / Sn II ) = +0.15 V. Roztwory HF są łatwo utleniane przez szereg utleniaczy (O 2 , SO 2 lub F 2 ) do tworzą związek o mieszanej wartościowości Sn 3 F 8 (zawierający Sn II i Sn IV oraz bez wiązań Sn–Sn).
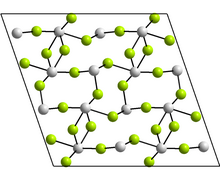
Struktura
Postać jednoskośna zawiera tetramery Sn 4 F 8 , gdzie istnieją dwa różne środowiska koordynacyjne dla atomów Sn. W każdym przypadku mamy trzech najbliższych sąsiadów, z Sn na wierzchołku piramidy trygonalnej i samotną parą elektronów aktywną sterycznie. Inne zgłoszone formy mają strukturę GeF 2 i paratelluryt .
Molekularny SnF 2
W fazie gazowej SnF 2 tworzy monomery, dimery i trimery. Monomeryczny SnF 2 jest nieliniową cząsteczką o długości wiązania Sn-F wynoszącej 206 µm. Kompleksy SNF 2 , zwany difluorostannylene, z alkinu i związków aromatycznych, osadzonych w matrycy argonu w temperaturze 12 K zostały zgłoszone.
Bezpieczeństwo
Fluorek cynawy może powodować zaczerwienienie i podrażnienie w przypadku wdychania lub kontaktu z oczami. W przypadku spożycia może powodować bóle brzucha i wstrząs. Możliwe są rzadkie, ale poważne reakcje alergiczne; objawy obejmują swędzenie, obrzęk i trudności w oddychaniu. Niektóre preparaty fluorku cynawego w produktach dentystycznych mogą powodować łagodne przebarwienia zębów ; nie jest to trwałe i można je usunąć przez szczotkowanie lub można temu zapobiec, stosując stabilizowaną pastę do zębów z fluorkiem cynawym.

