Proces termodynamiczny - Thermodynamic process
| Termodynamika |
|---|

|
Klasyczna termodynamika uwzględnia trzy główne rodzaje procesów termodynamicznych : (1) zmiany w systemie, (2) cykle w systemie oraz (3) procesy przepływu.
(1) Zmiana w układzie jest określona przez przejście od początkowego do końcowego stanu równowagi termodynamicznej . W klasycznej termodynamice rzeczywisty przebieg procesu nie jest głównym problemem i często jest ignorowany. Stan równowagi termodynamicznej trwa niezmiennie, chyba że zostanie przerwany przez operację termodynamiczną, która inicjuje proces termodynamiczny. Każdy ze stanów równowagi jest odpowiednio w pełni określony przez odpowiedni zestaw termodynamicznych zmiennych stanu, które zależą tylko od aktualnego stanu układu, a nie od drogi, jaką przebyły procesy, które go wytwarzają. Ogólnie rzecz biorąc, podczas rzeczywistego przebiegu procesu termodynamicznego układ może przechodzić przez stany fizyczne, których nie można opisać jako stany termodynamiczne, ponieważ są one dalekie od wewnętrznej równowagi termodynamicznej. Termodynamika nierównowagowa uwzględnia jednak procesy, w których stany układu są bliskie równowadze termodynamicznej, i ma na celu opisanie ciągłego przejścia wzdłuż ścieżki, w określonym tempie postępu.
Jako użyteczny teoretyczny, ale nie fizycznie możliwy do zrealizowania przypadek graniczny, można sobie wyobrazić, że proces zachodzi praktycznie nieskończenie powoli lub wystarczająco gładko, aby można go było opisać ciągłą ścieżką stanów równowagi termodynamicznej, kiedy nazywa się go „ quasi-statycznym”. " proces. Jest to ćwiczenie teoretyczne z geometrii różniczkowej, w przeciwieństwie do opisu faktycznie możliwego procesu fizycznego; w tym wyidealizowanym przypadku obliczenia mogą być dokładne.
Naprawdę możliwy lub rzeczywisty proces termodynamiczny, rozważany z bliska, obejmuje tarcie. Kontrastuje to z teoretycznie wyidealizowanymi, wyobrażonymi lub ograniczającymi, ale w rzeczywistości niemożliwymi, procesami quasi-statycznymi, które mogą zachodzić z teoretyczną powolnością, która pozwala uniknąć tarcia. Kontrastuje to również z wyidealizowanymi, pozbawionymi tarcia procesami w otoczeniu, które można uważać za obejmujące „systemy czysto mechaniczne”; ta różnica zbliża się do zdefiniowania procesu termodynamicznego.
(2) Proces cykliczny prowadzi system przez cykl etapów, rozpoczynających się i kończących się w określonym stanie. Opisy etapowych stanów systemu nie są głównym problemem. Podstawowym problemem są sumy wejść i wyjść materii i energii w cyklu. Procesy cykliczne były ważnymi urządzeniami koncepcyjnymi we wczesnych dniach badań termodynamicznych, podczas gdy koncepcja zmiennej stanu termodynamicznego była rozwijana.
(3) Zdefiniowany przez przepływy przez system, proces przepływu jest ustalonym stanem przepływów do iz naczynia o określonych właściwościach ścian. Stan wewnętrzny zawartości naczynia nie jest głównym problemem. Wielkości o podstawowym znaczeniu opisują stany dopływu i odpływu materiałów, a z boku przenoszenie ciepła, pracy oraz energii kinetycznej i potencjalnej dla naczynia. Procesy przepływowe są przedmiotem zainteresowania inżynierii.
Rodzaje procesu
Proces cykliczny
Zdefiniowany przez cykl transferów do iz systemu, proces cykliczny jest opisywany przez ilości transferowane w kilku etapach cyklu. Opisy stanów etapowych systemu mogą być mało interesujące lub nawet nie być interesujące. Cykl to sekwencja niewielkiej liczby procesów termodynamicznych, która w nieskończoność często, wielokrotnie przywraca układ do stanu pierwotnego. W tym celu same stany etapowe niekoniecznie są opisywane, ponieważ to właśnie transfery są przedmiotem zainteresowania. Uważa się, że jeśli cykl może być powtarzany w nieskończoność często, to można założyć, że stany są stale niezmienione. Stan systemu podczas kilku etapowych procesów może być nawet mniej interesujący niż dokładny charakter stanów powtarzających się. Jeśli jednak kilka etapowych procesów jest wyidealizowanych i quasi-statycznych, to cykl jest opisany ścieżką przez ciągły postęp stanów równowagi.
Proces przepływu
Zdefiniowany przez przepływy przez system, proces przepływu jest ustalonym stanem przepływu do iz naczynia o określonych właściwościach ścian. Stan wewnętrzny zawartości naczynia nie jest głównym problemem. Wielkości o podstawowym znaczeniu opisują stany dopływu i odpływu materiałów, a z boku przenoszenie ciepła, pracy oraz energii kinetycznej i potencjalnej dla naczynia. Na stany materiałów dopływowych i odpływowych składają się ich stany wewnętrzne oraz ich energia kinetyczna i potencjalna jako całe ciała. Bardzo często wielkości opisujące stany wewnętrzne materiałów wejściowych i wyjściowych szacowane są przy założeniu, że są one ciałami we własnych stanach wewnętrznej równowagi termodynamicznej. Ponieważ dozwolone są szybkie reakcje, obróbka termodynamiczna może być przybliżona, a nie dokładna.
Cykl procesów quasi-statycznych
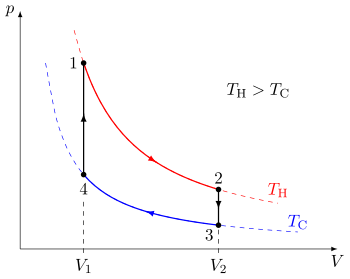
Quasi-statyczny proces termodynamiczny można zwizualizować poprzez graficzne wykreślenie ścieżki wyidealizowanych zmian zmiennych stanu systemu . W przykładzie pokazano cykl składający się z czterech procesów quasi-statycznych. Każdy proces ma dobrze zdefiniowany punkt początkowy i końcowy w przestrzeni stanów ciśnienie-objętość . W tym konkretnym przykładzie procesy 1 i 3 są izotermiczne , podczas gdy procesy 2 i 4 są izochoryczne . Schemat PV jest szczególnie użyteczna do wizualizacji procesu quasi-statyczne, ponieważ pole powierzchni pod krzywą dla procesu jest to ilość prac wykonywanych przez system w trakcie tego procesu. Tak więc praca jest uważana za zmienną procesową , ponieważ jej dokładna wartość zależy od konkretnej drogi przebytej między punktem początkowym a końcowym procesu. Podobnie ciepło może być przenoszone podczas procesu i również jest zmienną procesową.
Sprzężone procesy zmienne
Często przydatne jest grupowanie procesów w pary, w których każda zmienna utrzymywana na stałym poziomie jest jednym członkiem pary sprzężonej .
Ciśnienie – objętość
Para sprzężonych ciśnienie-objętość dotyczy przekazywania energii mechanicznej w wyniku pracy.
- Izobaryczna proces odbywa się przy stałym ciśnieniu. Przykładem może być posiadanie ruchomego tłoka w cylindrze, tak aby ciśnienie wewnątrz cylindra było zawsze równe ciśnieniu atmosferycznemu, chociaż jest ono oddzielone od atmosfery. Innymi słowy, system jest dynamicznie połączony przez ruchomą granicę ze zbiornikiem o stałym ciśnieniu.
- Izochoryczne proces jest taka, w której objętość jest utrzymywana na stałym poziomie, co powoduje, że praca mechaniczna PV odbywa się poprzez system będzie zero. Z drugiej strony praca może być wykonywana w układzie izochorycznie, na przykład za pomocą wału napędzającego obrotową łopatkę znajdującą się wewnątrz układu. Wynika z tego, że dla prostego układu o jednej zmiennej odkształcenia każda energia cieplna przekazana do układu na zewnątrz zostanie pochłonięta jako energia wewnętrzna. Proces izochoryczny jest również znany jako proces izometryczny lub proces izowolumetryczny . Przykładem może być umieszczenie zamkniętej puszki z materiałem w ogniu. W pierwszym przybliżeniu puszka nie rozszerzy się, a jedyną zmianą będzie to, że zawartość nabierze energii wewnętrznej, o czym świadczy wzrost temperatury i ciśnienia. Matematycznie . System jest dynamicznie izolowany sztywną granicą od otoczenia.
Temperatura – entropia
Para koniugatów temperatura-entropia dotyczy przekazywania energii, zwłaszcza w układzie zamkniętym.
- Przemiana izotermiczna występuje w stałej temperaturze. Przykładem może być układ zamknięty zanurzony w dużej łaźni o stałej temperaturze i połączony termicznie z nią. Energia pozyskiwana przez system w wyniku wykonanej na nim pracy jest tracona do kąpieli, dzięki czemu jej temperatura pozostaje stała.
- Adiabatyczne proces jest procesem, w którym znajduje się niezależnie od tego, czy ciepło transferu, gdyż ścianka termoizolacyjna oddziela systemu z otoczenia. Aby proces był naturalny, albo (a) praca musi być wykonywana w systemie w skończonym tempie, tak aby energia wewnętrzna systemu wzrastała; entropia systemu wzrasta pomimo izolacji termicznej; lub (b) system musi pracować nad otoczeniem, które następnie cierpi na wzrost entropii, a także pozyskuje energię z systemu.
- Izentropowe proces jest zazwyczaj zdefiniowany jako wyidealizowany odwracalnym procesie adiabatycznego quasi-statyczny, transfer energii jako pracy. W przeciwnym razie, w przypadku procesu o stałej entropii, jeśli praca jest wykonywana nieodwracalnie, konieczny jest transfer ciepła, tak aby proces nie był adiabatyczny i konieczny jest dokładny mechanizm sztucznej kontroli; nie jest to zatem zwykły naturalny proces termodynamiczny.
Potencjał chemiczny - liczba cząstek
Powyższe procesy zakładają, że granice są również nieprzepuszczalne dla cząstek. W przeciwnym razie możemy założyć, że granice są sztywne, ale przepuszczalne dla jednego lub więcej rodzajów cząstek. Podobne rozważania dotyczą następnie potencjału chemicznego – pary sprzężonej liczby cząstek , która dotyczy przekazywania energii poprzez ten transfer cząstek.
- W procesie o stałym potencjale chemicznym system jest połączony transferowo przez granicę przepuszczalną dla cząstek ze zbiornikiem o stałym µ.
- Koniugat jest tutaj procesem o stałej liczbie cząstek. Są to procesy opisane powyżej. Nie ma energii dodanej ani odejmowanej od systemu przez transfer cząstek. System jest izolowany od otoczenia przez transfer cząstek przez granicę nieprzepuszczalną dla cząstek, ale pozwalającą na transfer energii w postaci pracy lub ciepła. Procesy te są tymi, dzięki którym definiuje się pracę termodynamiczną i ciepło i dla nich mówi się, że układ jest zamknięty .
Potencjały termodynamiczne
Dowolny z potencjałów termodynamicznych może być utrzymywany na stałym poziomie podczas procesu. Na przykład:
- Isenthalpic proces wprowadza żadnych zmian entalpii w systemie.
Procesy politropowe
Politropowe proces jest termodynamiczny proces, który słucha relacji:
gdzie P to ciśnienie, V to objętość, n to dowolna liczba rzeczywista („wskaźnik politropowy”), a C to stała. Równanie może być wykorzystane do dokładnego scharakteryzowania procesów niektórych systemach , zwłaszcza na ściskanie lub ekspansji z gazu , ale w niektórych przypadkach, cieczy i ciał stałych .
Procesy klasyfikowane według drugiej zasady termodynamiki
Według Plancka można pomyśleć o trzech głównych klasach procesów termodynamicznych: naturalnym, fikcyjnie odwracalnym oraz niemożliwym lub nienaturalnym.
Naturalny proces
W przyrodzie zachodzą tylko naturalne procesy. W termodynamice naturalnym procesem jest transfer między systemami, który zwiększa sumę ich entropii i jest nieodwracalny. Naturalne procesy mogą zachodzić samoistnie po usunięciu ograniczenia lub po jakiejś innej operacji termodynamicznej , lub mogą być uruchomione w układzie metastabilnym lub niestabilnym, jak na przykład kondensacja pary przesyconej. Planck podkreślił występowanie tarcia jako ważnej cechy naturalnych procesów termodynamicznych, które obejmują transfer materii lub energii między systemem a otoczeniem.
Fikcyjnie odwracalny proces
Aby opisać geometrię powierzchni graficznych ilustrujących relacje równowagi między termodynamicznymi funkcjami stanu, można fikcyjnie pomyśleć o tzw. „procesach odwracalnych”. Są wygodnymi obiektami teoretycznymi, które śledzą ścieżki po powierzchniach graficznych. Nazywane są „procesami”, ale nie opisują naturalnie występujących procesów, które zawsze są nieodwracalne. Ponieważ punkty na ścieżkach są punktami równowagi termodynamicznej, zwyczajowo uważa się, że „procesy” opisane przez ścieżki są fikcyjnie „odwracalne”. Procesy odwracalne są zawsze procesami quasistatycznymi, ale nie zawsze jest odwrotnie.
Nienaturalny proces
Logicznie można sobie wyobrazić procesy nienaturalne, ale nie występują one w naturze. Zmniejszyłyby sumę entropii, gdyby wystąpiły.
Proces quasistatyczny
Ąuasistatyczną oznaczoną za pomocą procesu stanowi wyidealizowany lub fikcyjną model termodynamicznych „proces” będących w badaniach teoretycznych. Nie występuje w rzeczywistości fizycznej. Można sobie wyobrazić, że dzieje się to nieskończenie powoli, tak że układ przechodzi przez kontinuum stanów, które są nieskończenie bliskie równowadze .
Zobacz też
Bibliografia
Dalsza lektura
- Fizyka dla naukowców i inżynierów - z nowoczesną fizyką (6 wydanie), PA Tipler, G. Mosca, Freeman, 2008, ISBN 0-7167-8964-7
- Encyklopedia Fizyki (2nd Edition), RG Lerner , GL Trigg, wydawcy VHC, 1991, ISBN 3-527-26954-1 (Verlagsgesellschaft), ISBN 0-89573-752-3 (VHC Inc.)
- Encyklopedia fizyki McGraw Hill (wydanie drugie), CB Parker, 1994, ISBN 0-07-051400-3
- Fizyka z nowoczesnymi zastosowaniami , LH Greenberg, Holt-Saunders International WB Saunders and Co, 1978, ISBN 0-7216-4247-0
- Essential Principles of Physics , PM Whelan, MJ Hodgeson, wydanie 2, 1978, John Murray, ISBN 0-7195-3382-1
- Termodynamika, Od pojęć do zastosowań (2nd Edition), A. Shavit, C. Gutfinger, CRC Press (Taylor and Francis Group, USA), 2009, ISBN 9781420073683
- Termodynamika chemiczna , DJG Ives, Chemia uniwersytecka, Macdonald Technical and Scientific, 1971, ISBN 0-356-03736-3
- Elementy termodynamiki statystycznej (2nd Edition), LK Nash, Principles of Chemistry, Addison-Wesley, 1974, ISBN 0-201-05229-6
- Fizyka statystyczna (2nd Edition), F. Mandl, Manchester Fizyka, John Wiley & Sons, 2008, ISBN 9780471915331













