Spin izomery wodoru - Spin isomers of hydrogen
Wodór cząsteczkowy występuje w dwóchformach izomerycznych , jedna z dwoma spinami jądra protonówułożonymi równolegle (ortowodór), druga z dwoma spinami protonów ułożonymi równolegle (parawodór). Te dwie formy są często określane jako izomery spinowe.
Parawodór jest w niższym stanie energetycznym niż ortowodór. W temperaturze pokojowej i w równowadze termicznej wzbudzenie termiczne powoduje, że wodór składa się w około 75% z ortowodoru i 25% z parawodoru. Gdy wodór jest upłynniany w niskiej temperaturze, następuje powolne spontaniczne przejście do stosunku głównie para, a uwolniona energia ma wpływ na przechowywanie. Zasadniczo czystą formę parawodorową można otrzymać w bardzo niskich temperaturach, ale nie jest możliwe uzyskanie próbki zawierającej więcej niż 75% ortowodoru przez ogrzewanie.
Mieszanina lub mieszanina 50:50 orto- i parawodoru może być sporządzona w laboratorium, przepuszczając ją przez katalizator z tlenku żelaza(III) w temperaturze ciekłego azotu (77 K) lub przechowując wodór w 77 K przez 2–3 godziny w obecność węgla aktywowanego. W przypadku braku katalizatora, relaksacja parawodoru w fazie gazowej do normalnego wodoru w temperaturze pokojowej zajmuje kilka dni, podczas gdy w rozpuszczalnikach organicznych zajmuje to kilka godzin.
Jądrowe stany spinowe H 2
Każda cząsteczka wodoru ( H
2) składa się z dwóch atomów wodoru połączonych wiązaniem kowalencyjnym . Jeśli pominiemy niewielki udział deuteru i trytu, który może być obecny, każdy atom wodoru składa się z jednego protonu i jednego elektronu . Z każdym protonem związany jest moment magnetyczny , który jest powiązany z spinem protonu 1 ⁄ 2 . W H
2spiny dwóch jąder wodoru (protonów) łączą się, tworząc stan tripletowy znany jako ortowodór i stan singletowy znany jako parawodór .
Stan ortowodorowy tripletowy ma całkowity spin jądrowy I = 1, tak że składnik wzdłuż określonej osi może mieć trzy wartości M I = 1, 0 lub -1. Odpowiednie funkcje falowe spinu jądrowego to , i . Używa standardowej notacji klamrowej ; symbol ↑ reprezentuje funkcję falową spin-up, a symbol ↓ funkcję falową spin-down dla jądra, więc ↑↓ oznacza, że pierwsze jądro jest w górę, a drugie w dół. Każdy poziom energii ortowodoru ma wtedy (jądrową) degenerację spinu wynoszącą trzy, co oznacza, że odpowiada trzem stanom o tej samej energii (przy braku pola magnetycznego). Singletowy stan parawodorowy ma nuklearne liczby kwantowe I = 0 i M I = 0, z funkcją falową . Ponieważ istnieje tylko jedna możliwość, każdy poziom parawodoru ma degenerację spinową wynoszącą jeden i mówi się, że jest niezdegenerowany.
Dozwolone poziomy energii rotacyjnej
Ponieważ protony mają spin 1 ⁄ 2 , są fermionami i permutacyjną antysymetrią całkowitego H
2funkcja falowa nakłada ograniczenia na możliwe stany rotacyjne dwóch form H
2. Ortowodór, z symetrycznymi funkcjami spinu jądrowego, może mieć tylko rotacyjne funkcje falowe, które są antysymetryczne względem permutacji dwóch protonów, odpowiadające nieparzystym wartościom rotacyjnej liczby kwantowej J ; odwrotnie, parawodór z antysymetryczną funkcją spinu jądrowego może mieć tylko rotacyjne funkcje falowe, które są symetryczne względem permutacji dwóch protonów, odpowiadające nawet J .
Forma para, której najniższy poziom wynosi J = 0, jest bardziej stabilna o 1,455 kJ/mol niż forma orto, której najniższy poziom wynosi J = 1. Stosunek liczby cząsteczek orto i para wynosi około 3:1 w standardowej temperaturze, gdzie wiele rotacyjnych poziomy energetyczne są wypełniane, faworyzując formę orto w wyniku energii cieplnej. Jednak w niskich temperaturach tylko poziom J = 0 jest znacznie zaludniony, tak że forma para dominuje w niskich temperaturach (około 99,8% w 20 K). Ciepło parowania jest tylko 0,904 kJ / mol. W rezultacie orto-ciekły wodór równoważący się do postaci para uwalnia wystarczającą ilość energii, aby spowodować znaczne straty podczas wrzenia.
Właściwości termiczne
Stosując przybliżenie sztywnego wirnika , energie i degeneracje stanów rotacyjnych wyraża się wzorem:
- .
Funkcja podziału obrotowego jest umownie zapisywana jako:
- .
Jednak dopóki oba izomery spinowe nie są w równowadze, bardziej przydatne jest napisanie oddzielnych funkcji podziału dla każdego z nich:
Współczynnik 3 w funkcji podziału dla ortowodoru odpowiada za degenerację spinu związaną ze stanem spinu +1; gdy równowaga między izomerami spinu jest możliwa, to ogólna funkcja podziału obejmująca tę różnicę degeneracji może być zapisana jako:
Molowe energie obrotowe i pojemności cieplne są wyprowadzane dla każdego z tych przypadków z:
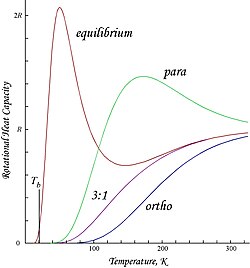
Pokazane tutaj wykresy to molowe energie obrotowe i pojemności cieplne dla orto- i parawodoru oraz „normalny” stosunek orto:para (3:1) i mieszaniny równowagowe:
Ze względu na narzucone antysymetrią ograniczenie możliwych stanów rotacyjnych, ortowodór ma resztkową energię rotacyjną w niskiej temperaturze, w której prawie wszystkie cząsteczki są w stanie J = 1 (cząsteczki w symetrycznym stanie spinowo-trypletowym nie mogą spaść w najniższy, symetryczny stan rotacyjny ) i posiada entropię spinu jądrowego z powodu potrójnej degeneracji stanu tripletowego. Energia resztkowa jest znacząca, ponieważ poziomy energii rotacyjnej są stosunkowo szeroko rozstawione w H
2; różnica między pierwszymi dwoma poziomami wyrażona w jednostkach temperatury jest dwukrotnością charakterystycznej temperatury obrotowej dla H
2:
- .
Jest to punkt przecięcia T = 0 widoczny w energii molowej ortowodoru. Ponieważ „normalny” wodór w temperaturze pokojowej jest mieszaniną orto:para 3:1, jego molowa resztkowa energia obrotowa w niskiej temperaturze wynosi (3/4) × 2 Rθ rot ≈ 1091 J/mol, co jest nieco większe niż entalpia odparowanie normalnego wodoru, 904 J / mol, w temperaturze wrzenia, T b ≈ 20.369 K. w szczególności, temperatury wrzenia parawodoru i normalnych (3: 1) atom wodoru są prawie równe; dla parawodór AH VAP ≈ 898 J / mol w T b ≈ 20.277 K i wynika, że praktycznie cały pozostały energia obrotowa orto- pozostaje w stanie ciekłym.
Jednak ortowodór jest termodynamicznie niestabilny w niskich temperaturach i samorzutnie przekształca się w parawodór. Procesowi temu brakuje naturalnego trybu promieniowania de-wzbudzenie, więc jest powolny przy braku katalizatora, który może ułatwiać wzajemne przekształcanie stanów spinu singletowego i tripletowego. W temperaturze pokojowej wodór zawiera 75% ortowodoru, proporcję, którą zachowuje proces upłynniania, jeśli jest przeprowadzany bez katalizatora, takiego jak tlenek żelaza , węgiel aktywny , platynowany azbest, metale ziem rzadkich, związki uranu, tlenek chromu lub niektóre związki niklu w celu przyspieszenia konwersji ciekłego wodoru w parawodór. Alternatywnie, dodatkowy sprzęt chłodniczy może być użyty do powolnego pochłaniania ciepła, które frakcja ortowodorowa będzie (wolniej) uwalniać, ponieważ spontanicznie przekształca się w parawodór. Jeśli ortowodór nie zostanie usunięty z szybko skroplonego wodoru, bez katalizatora, ciepło uwolnione podczas jego rozpadu może wygotować nawet 50% oryginalnej cieczy.
Historia
Niezwykłą pojemność cieplną wodoru odkrył w 1912 roku Arnold Eucken . Dwie formy wodoru cząsteczkowego zostały po raz pierwszy zaproponowane przez Wernera Heisenberga i Friedricha Hunda w 1927 roku. Biorąc pod uwagę te ramy teoretyczne, czysty parawodór został po raz pierwszy zsyntetyzowany przez Paula Hartecka i Karla Friedricha Bonhoeffera w 1929 roku w Instytucie Chemii Fizycznej i Elektrochemii im . Kaisera Wilhelma . Kiedy Heisenberg otrzymał w 1932 roku nagrodę Nobla w dziedzinie fizyki za stworzenie mechaniki kwantowej, to odkrycie „alotropowych form wodoru” zostało wyróżnione jako najbardziej godne uwagi zastosowanie. Dalsze prace nad właściwościami i reaktywnością chemiczną parawodoru prowadzili w następnej dekadzie Elly Agallidis i Georg-Maria Schwab .
Nowoczesna izolacja czystego parawodoru została od tego czasu osiągnięta przy użyciu szybkiego osadzania pod próżnią stałego parawodoru o grubości milimetrów (p– H
2) próbki, które wyróżniają się doskonałymi właściwościami optycznymi.
Zastosowanie w NMR i MRI
Gdy podczas reakcji uwodorniania stosuje się nadmiar parawodoru (zamiast normalnej mieszaniny ortowodoru do parawodoru 3:1), otrzymany produkt wykazuje hiperpolaryzowane sygnały w widmach protonowego NMR , efekt określany jako PHIP (polaryzacja indukowana parawodorem) lub, równoważnie, PASADENA (Parahydrogen And Synthesis Allow Dramatically Enhanced Nuclear Alignment; nazwany tak od pierwszego rozpoznania efektu przez Bowersa i Weitekampa z Caltech ), zjawiska, które zostało wykorzystane do badania mechanizmu reakcji uwodornienia.
Wzmacnianie sygnału przez odwracalną wymianę (SABRE) to technika hiperpolaryzacji próbek bez ich chemicznej modyfikacji. W porównaniu z cząsteczkami ortowodorowymi lub organicznymi, znacznie większa część jąder wodoru w parawodorze dopasowuje się do przyłożonego pola magnetycznego. W SABRE centrum metalu odwracalnie wiąże się zarówno z cząsteczką testowaną, jak i cząsteczką parawodoru, ułatwiając cząsteczce docelowej wychwycenie polaryzacji parawodoru. Technikę tę można ulepszyć i wykorzystać dla szerokiej gamy cząsteczek organicznych, stosując pośrednią cząsteczkę „przekaźnikową”, taką jak amoniak. Amoniak skutecznie wiąże się z metalowym centrum i odbiera polaryzację z parawodoru. Amoniak przenosi następnie inne cząsteczki, które nie wiążą się tak dobrze z metalowym katalizatorem. Ten wzmocniony sygnał NMR umożliwia szybką analizę bardzo małych ilości materiału i ma ogromny potencjał do zastosowań w obrazowaniu metodą rezonansu magnetycznego .
Deuter
Dwuatomowy deuteru ( D
2) ma izomery spinu jądrowego, takie jak wodór dwuatomowy, ale z różnymi populacjami tych dwóch form, ponieważ jądro deuteru (deuteron) jest bozonem o spinze jądrowym równym jeden. Istnieje sześć możliwych jądrowych funkcji fal spinowych, które są orto lub symetryczne do wymiany dwóch jąder, a trzy są para lub antysymetryczne. Stany orto odpowiadają parzystym poziomom rotacyjnym z symetrycznymi funkcjami rotacyjnymi, tak że całkowita funkcja falowa jest symetryczna zgodnie z wymaganiami wymiany dwóch bozonów, a stany para odpowiadają nieparzystym poziomom rotacyjnym. Stan podstawowy ( J = 0) zaludniony w niskiej temperaturze to orto, a w standardowej temperaturze stosunek orto:para wynosi 2:1.
Inne substancje z izomerami spinowymi
Inne cząsteczki i grupy funkcyjne zawierające dwa atomy wodoru, takie jak woda i metylen (CH 2 ), również mają orto- i para-formy (np. ortowoda i parawoda), ale ma to niewielkie znaczenie dla ich właściwości termicznych. Ich stosunki orto:para różnią się od diwodoru. Ostatnio wyizolowano formy orto i para wody.
Tlen cząsteczkowy ( O
2) występuje również w trzech stanach trypletowych o niższej energii i jednym stanie singletowym, jako paramagnetyczny tlen trypletowy w stanie podstawowym i aktywowany wysoce reaktywny diamagnetyczny tlen singletowy . Stany te powstają z spinów ich niesparowanych elektronów , a nie z ich protonów czy jąder.
Bibliografia
Dalsza lektura
- Aline Leon, wyd. 2008, Hydrogen Technology: Mobile and Portable Applications, pp 93-101 , New York, NY: Springer Science & Business, ISBN 3-540-69925-2 , patrz [1] , dostęp 10 maja 2015 r.
- Tichonow VI, Wołkow AA (2002). „Rozdzielenie wody na izomery orto i para” . Nauka . 296 (5577): 2363. doi : 10.1126/science.1069513 . PMID 12089435 . S2CID 26190863 .
- Mario E. Fajardo; Simon Tam (1997). Szybkie osadzanie par milimetrowych, optycznie przezroczystych, stałych próbek parawodoru do spektroskopii z izolacją matrycy . Edwards AFB (Dyrekcja Napędu Zachodniego): Laboratorium Badawcze USAF.CS1 maint: wiele nazwisk: lista autorów ( link )
- Bowers, CR; Weitekamp, DP (1986). „Przekształcenie porządku symetryzacji do namagnesowania spinu jądrowego w wyniku reakcji chemicznej i magnetycznego rezonansu jądrowego” (PDF) . Fiz. Ks . 57 (21): 2645–2648. Kod Bibcode : 1986PhRvL..57.2645B . doi : 10.1103/physrevlett.57.2645 . PMID 10033824 .
- A. Farkasa (1935). Ortowodór, parawodór i wodór ciężki . Seria Cambridge chemii fizycznej. Cambridge, Wielka Brytania: CUP .
- Bonhoeffer KF , Harteck P (1929). „Para- i orto wodór”. Zeitschrift für Physikalische Chemie B . 4 (1–2): 113–141.
- Oxford Instruments, data nieznana, „Zwiększenie czułości spektroskopii NMR przy użyciu parawodoru”