Pektynesteraza - Pectinesterase
| pektynesteraza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Identyfikatory | |||||||||
| Nr WE | 3.1.1.11 | ||||||||
| Nr CAS | 9025-98-3 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRIAM | profil | ||||||||
| Struktury WPB | RCSB PDB PDBe Suma PDB | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Pektynesteraza (PE) ( EC 3.1.1.11 ) jest wszechobecnym enzymem związanym ze ścianą komórkową, który występuje w kilku izoformach, które ułatwiają modyfikację ściany komórkowej rośliny, a następnie jej rozpad. Występuje we wszystkich roślinach wyższych, a także w niektórych bakteriach i grzybach . Pektinesteraza działa głównie poprzez zmianę zlokalizowanego pH ściany komórkowej, powodując zmiany w integralności ściany komórkowej.
Pectinesterase katalizuje deestryfikacji z pektyny do pektynianu i metanolu . Pektyna jest jednym z głównych składników ściany komórkowej roślin. W roślinach pektynesteraza odgrywa ważną rolę w metabolizmie ściany komórkowej podczas dojrzewania owoców. W roślinnych patogenach bakteryjnych, takich jak Erwinia carotovora oraz w patogenach grzybowych, takich jak Aspergillus niger , pektynesteraza bierze udział w maceracji i miękkiej gniciu tkanki roślinnej. Pektynesterazy roślinne są regulowane przez inhibitory pektynesterazy, które są nieskuteczne wobec enzymów drobnoustrojowych.
Funkcjonować
Ostatnie badania wykazały, że manipulacja ekspresją pektynesterazy może wpływać na wiele procesów fizjologicznych. W roślinach pektynesteraza odgrywa rolę w modulowaniu stabilności mechanicznej ściany komórkowej podczas dojrzewania owoców , wydłużaniu ściany komórkowej podczas kiełkowania pyłku i wzrostu łagiewki pyłkowej , odcinaniu , wydłużaniu łodygi, plonowaniu bulw i rozwoju korzeni. Wykazano również, że pektinesteraza odgrywa rolę w odpowiedzi roślin na atak patogenów . Pektynesteraza związana ze ścianą komórkową Nicotiana tabacum jest zaangażowana w rozpoznawanie receptora komórki gospodarza dla białka ruchu wirusa mozaiki tytoniu i wykazano, że ta interakcja jest wymagana do translokacji wirusa z komórki do komórki.
Działanie pektynesterazy na składniki ściany komórkowej roślin może wywołać dwa diametralnie przeciwne efekty. Pierwszym jest wkład w usztywnienie ściany komórkowej poprzez wytwarzanie bloków nieestryfikowanych grup karboksylowych , które mogą oddziaływać z jonami wapnia tworząc żel pektynianowy. Drugim jest to, że uwalnianie protonów może stymulować aktywność hydrolaz ściany komórkowej, przyczyniając się do rozluźnienia ściany komórkowej.
Estryfikacja pektyny
Pektyny stanowią około 35% suchej masy dwuliściennych ścian komórkowych. Są one spolimeryzowane w cis aparatu Golgiego , estryfikowane metylem w środkowej części aparatu Golgiego i podstawione łańcuchami bocznymi w cysternach trans aparatu Golgiego. Biochemia pektyn może być dość skomplikowana, ale mówiąc prościej, szkielet pektyny składa się z 3 rodzajów polimerów: homogalakturonu (HGA); ramnogalakturonian I (RGI); ramnogalakturonian II (RGII).
Homogalakturonan jest silnie zestryfikowany metylem po wyeksportowaniu do ścian komórkowych, a następnie jest deestryfikowany przez działanie pektynesterazy i innych enzymów pektynowych. Pektinesteraza katalizuje deestryfikację estryfikowanych metylem jednostek kwasu D-galaktozyduronowego w związkach pektynowych, dając substraty dla enzymów depolimeryzujących, zwłaszcza kwaśnych pektyn i metanolu .
Większość oczyszczonych pektynesteraz roślinnych ma neutralne lub zasadowe punkty izoelektryczne i jest związana ze ścianą komórkową poprzez oddziaływania elektrostatyczne . Pektinesterazy mogą jednak wykazywać kwaśne punkty izoelektryczne wykrywane w rozpuszczalnych frakcjach tkanek roślinnych. Do niedawna ogólnie zakładano, że pektynesterazy roślinne usuwają estry metylowe w sposób progresywny, blokowy, powodując powstanie długich ciągłych ciągów niezestryfikowanych reszt GalA w domenach homogalakturonu pektyny . Alternatywnie uważano, że pektynesterazy grzybowe mają losową aktywność, co skutkuje deestryfikacją pojedynczych reszt GalA na oddziaływania enzym/substrat. Wykazano obecnie , że niektóre izoformy pektynesterazy roślinnej mogą wykazywać oba mechanizmy i że takie mechanizmy są napędzane zmianami pH . Optymalne pH roślin wyższych wynosi zwykle od pH 7 do pH 8, chociaż pH pektynesterazy z grzybów i bakterii jest zwykle znacznie niższe.
Biologia molekularna i biochemia
Białka PE są syntetyzowane jako prebiałka o długości 540-580 aminokwasów, posiadające sekwencję sygnałową i duże wydłużenie końca aminowego około 22 kDa . To końcowe wydłużenie jest ostatecznie usuwane z wytworzeniem dojrzałego białka o 34-37 kDa. Większość PE nie ma sekwencji konsensusowych dla N-glikozylacji w dojrzałym białku, chociaż co najmniej jedno miejsce jest obecne w regionie wydłużania końca aminowego.
Przestrzenna i czasowa regulacja aktywności pektynesterazy podczas rozwoju roślin opiera się na dużej rodzinie izoform. Ostatnio systematyczne sekwencjonowanie genomu Arabidopsis thaliana doprowadziło do identyfikacji 66 otwartych ramek odczytu, które są opisane jako pektynesterazy, z których większość jest zakodowana jako duże preproproteiny. Preregion peptydu sygnałowego jest wymagany do kierowania enzymu do retikulum endoplazmatycznego i składa się z około 25 reszt aminokwasowych. Te regiony N-końcowe zawierają kilka miejsc glikozylacji i uważa się, że te miejsca również odgrywają rolę w ukierunkowywaniu.
Uważa się, że pektynesteraza jest wydzielana do apoplazmy z wysoce zmetylowaną pektyną, chociaż w pewnym punkcie tej ścieżki sekrecyjnej N-końcowy propeptyd jest odcinany. Obecnie rola pro-regionu jest nieznana, choć wysunięto hipotezę, że może on działać jako wewnątrzcząsteczkowy chaperon, zapewniając prawidłowe fałdowanie lub dezaktywację aktywności do czasu całkowitego wprowadzenia PE do ściany komórkowej.
Ostatnio szczególną uwagę zwrócono na badania molekularne pektinesterazy prowadzące do scharakteryzowania kilku pokrewnych izoform w różnych gatunkach roślin wyższych. Wykazano, że niektóre z tych pektynesteraz ulegają wszechobecnej ekspresji, podczas gdy inne ulegają szczególnej ekspresji podczas dojrzewania owoców, kiełkowania ziarna pyłku lub wydłużania łodygi. Takie dane sugerują, że pektynesterzy są kodowane przez rodzinę genów, które są różnie regulowane w typie komórki w odpowiedzi na określone sygnały rozwojowe lub środowiskowe.
Izoformy roślinne
W roślinach dwuliściennych zidentyfikowano kilka izoform pektynesterazy różniących się masą cząsteczkową , punktem izoelektrycznym i aktywnością biochemiczną . Izoformy pektynesterazy są kodowane przez rodzinę genów, z których niektóre ulegają konstytutywnej ekspresji w całej roślinie, podczas gdy inne ulegają zróżnicowanej ekspresji w określonych tkankach i na różnych etapach rozwoju. Izoformy pektynesterazy różnią się różnymi parametrami biochemicznymi, takimi jak względna masa cząsteczkowa, punkt izoelektryczny, optymalne pH, powinowactwo substratu, zapotrzebowanie na jon i lokalizacja.
Struktura
| Pektynesteraza katalityczna | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||||||
| Symbol | Pectinesterase_cat | ||||||||||
| Pfam | PF01095 | ||||||||||
| InterPro | IPR000070 | ||||||||||
| PROSITE | PDOC00413 | ||||||||||
| |||||||||||
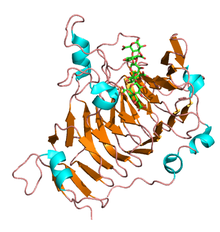
N-końcowe propeptydy pektynesterazy mają zmienną wielkość i sekwencję i wykazują niski poziom identyczności aminokwasów. Alternatywnie C-końcowy region katalityczny jest wysoce konserwatywny i stanowi dojrzały enzym. Pierwsza trójwymiarowa struktura rozwiązana dla roślinnej pektynesterazy dotyczyła izoformy z korzenia marchwi ( Daucus carota ) i składa się z prawoskrętnej równoległej β-helisy, jak widać we wszystkich rodzinach esteraz węglowodanowych CE-8, domenie transbłonowej i szczelina wiążąca pektynę. Podobnie kilka struktur pektynesterazy zostało wyjaśnionych w grzybach i E.coli i ma większość motywów strukturalnych obserwowanych u roślin.
Pektinesterazy prokariotyczne i eukariotyczne mają kilka regionów podobieństwa sekwencji. Struktura krystaliczna pektynesterazy z Erwinia chrysanthemi wykazała strukturę beta-helisy podobną do tej występującej w enzymach pektynolitycznych, chociaż różni się od większości struktur esteraz. Przypuszczalne reszty katalityczne znajdują się w podobnej lokalizacji do miejsca aktywnego i szczeliny wiążącej substrat liazy pektynianowej.
Bibliografia
Linki zewnętrzne
- pektynesteraza w amerykańskiej National Library of Medicine Medical Subject Headings (MeSH)
