Synteza Paala-Knorra - Paal–Knorr synthesis
| Synteza Paala-Knorra | |
|---|---|
| Nazwany po | Carl Paal Ludwig Knorr |
| Typ reakcji | Reakcja tworząca pierścień |
| Identyfikatory | |
| Identyfikator ontologii RSC | Numer RX: 0000161 |
Paal-Knorr syntezy w chemii organicznej jest reakcja, która powoduje albo furany , pirole lub tiofeny z 1,4-diketonów . Jest to cenna syntetycznie metoda otrzymywania podstawionych furanów i piroli, wspólnych składników strukturalnych wielu produktów naturalnych. Została ona początkowo opisana niezależnie przez niemieckich chemików Carla Paala i Ludwiga Knorra w 1884 roku jako metoda otrzymywania furanów i została zaadaptowana do piroli i tiofenów. Chociaż synteza Paala-Knorra znalazła szerokie zastosowanie, mechanizm nie został w pełni zrozumiany, dopóki nie został wyjaśniony przez V. Amarnatha i in. W latach dziewięćdziesiątych.
Synteza furanu wymaga katalizatora kwasowego:
W syntezie pirolu amina pierwszorzędowa uczestniczy:
aw tiofenu na przykład związek pentasiarczek fosforu :
Mechanizmy
Synteza furanu
| Synteza furanu Paala-Knorra | |
|---|---|
| Identyfikatory | |
| Portal Chemii Organicznej | Paal-knorr-synteza-furanu |
| Identyfikator ontologii RSC | Numer RX:0000162 |
Katalizowana kwasem synteza furanu przebiega przez protonowanie jednego karbonylu, który jest atakowany przez tworzący się enol drugiego karbonylu. Odwodnienie hemiacetalu daje powstały furan.
Mechanizm syntezy furanu Paala-Knorra został wyjaśniony w 1995 roku przez V. Amarnatha i in . Praca Amarnatha wykazała, że diastereoizomery 3,4-dipodstawionych-2,5-heksanodionów reagują z różną szybkością. W powszechnie akceptowanym mechanizmie, te diony przechodzą przez zwykły enolowy związek pośredni, co oznacza, że izomery mezo i d,l- racemiczne będą cyklizować z tą samą szybkością, z jaką tworzą się ze zwykłego związku pośredniego. Implikacją różnych reakcji jest to, że cyklizacja musi zachodzić w skoordynowanym etapie z tworzeniem enolu. Zaproponowano zatem, że mechanizm zachodzi poprzez atak protonowanego karbonylu tworzącym się enolem. Amarnath stwierdził również, że nieprzereagowany dion nie przeszedł izomeryzacji konformacyjnej, co również wskazuje, że enol nie jest związkiem pośrednim.
Synteza pirolu
| Synteza pirolu Paala-Knorra | |
|---|---|
| Identyfikatory | |
| Portal Chemii Organicznej | paal-knorr-synteza-pirolu |
| Identyfikator ontologii RSC | Numer RX: 0000164 |
Mechanizm syntezy pirolu zbadał V. Amarnath et al. w 1991. Jego praca sugeruje, że protonowany karbonyl jest atakowany przez aminę, tworząc hemiaminal. Amina atakuje inny karbonyl, tworząc pochodną 2,5-dihydroksytetrahydropirolu, która ulega odwodnieniu z wytworzeniem odpowiedniego podstawionego pirolu.
Reakcja jest typowo prowadzona w warunkach kwasowych protonowych lub Lewisa, z pierwszorzędową aminą. Zastosowanie wodorotlenku amonu lub octanu amonu (jak donosi Paal) daje N-niepodstawiony pirol.
Synteza tiofenu
| Synteza tiofenu Paala-Knorra | |
|---|---|
| Identyfikatory | |
| Portal Chemii Organicznej | Paal-knorr-synteza-tiofenu |
| Identyfikator ontologii RSC | Numer RX: 0000163 |
Synteza tiofenu odbywa się poprzez mechanizm bardzo podobny do syntezy furanu. Początkowy diketon jest przekształcany w tioketon za pomocą środka siarkującego , który następnie przechodzi ten sam mechanizm, co synteza furanu.
Większość środków siarkujących jest silnymi odwadniaczami i prowadzi do zakończenia reakcji. Wczesne postulaty dotyczące mechanizmu syntezy furanu Paala-Knorra sugerowały, że tiofen uzyskano przez siarkowanie produktu furanowego. Campaigne i Foye wykazali, że traktowanie wyizolowanych furanów z syntezy furanu Paal-Knorra pentasiarczkiem fosforu dało niespójne wyniki z traktowaniem 1,4-dikarbonyli pentasiarczkiem fosforu, co wykluczało siarkowanie mechanizmu furanu i sugeruje, że reakcja przebiega poprzez siarkowanie dikarbonylu, z wytworzeniem tioketonu .
Zakres
Reakcja Paala-Knorra jest dość wszechstronna. We wszystkich syntezach prawie wszystkie dikarbonyle można przekształcić w odpowiadające im heterocykle. R2 i R5 mogą oznaczać H, aryl lub alkil. R3 i R4 mogą oznaczać H, aryl, alkil lub ester. W syntezie pirolu (X = N), R1 może oznaczać H, aryl, alkil, grupę aminową lub hydroksyl.
Do przeprowadzenia tych reakcji można zastosować różne warunki, z których większość jest łagodna. Synteza Paala-Knorra Furana jest zwykle przeprowadzana w wodnych warunkach kwasowych z kwasami protonowymi, takimi jak wodny roztwór kwasu siarkowego lub chlorowodorowego, lub w warunkach bezwodnych z kwasem Lewisa lub środkiem odwadniającym. Typowe środki odwadniające obejmują pięciotlenek fosforu , bezwodniki lub chlorek cynku. Synteza pirolu wymaga pierwszorzędowej aminy w podobnych warunkach lub można zastosować amoniak (lub prekursory amoniaku). Synteza tiofenu wymaga środka siarkującego, który jest zazwyczaj wystarczającym środkiem odwadniającym, takim jak pentasiarczek fosforu , odczynnik Lawessona lub siarkowodór .
Tradycyjnie zakres reakcji Paala-Knorra był ograniczony przez dostępność 1,4-diketonów jako syntetycznych prekursorów. Obecne metody chemiczne znacznie rozszerzyły dostępność tych odczynników, a odmiany Paala-Knorra pozwalają teraz na stosowanie różnych prekursorów. Paal-Knorr był również uważany za ograniczony przez trudne warunki reakcji, takie jak przedłużone ogrzewanie w kwasie, które może degradować wrażliwe funkcje w wielu potencjalnych prekursorach furanu. Obecne metody pozwalają na łagodniejsze warunki, które mogą całkowicie uniknąć ciepła, w tym cyklizację katalizowaną mikrofalami .
Wariacje
Kilka surogatów 1,4-dikarbonylu może być użytych zamiast 1,4-dikarbonylu. Chociaż te substytuty mają inną strukturę niż 1,4-dikarbonyl, ich reakcje przebiegają poprzez mechanizmy bardzo podobne do mechanizmów Paala-Knorra.
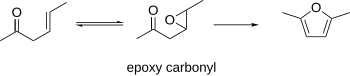
β-Karbonylki epoksydowe
Wiadomo, że β-epoksykarbonyle cyklizują do furanów. Ta procedura może wykorzystywać β-γ-nienasycone karbonyle jako materiały wyjściowe, które można epoksydować. Powstały epoksykarbonyl można cyklizować do furanu w warunkach kwasowych lub zasadowych.
1,4-Diol-2-yny
Systemy 1,4-diol-2-ynowe zostały również wykorzystane do przeprowadzenia chemii Paala-Knorra. Stosując pallad, 1,4-diol-2-ynę można izomeryzować in situ do odpowiedniego 1,4-diketonu, a następnie odwadniać do odpowiedniego furanu przy użyciu środka odwadniającego.
Znaczenie tej zmienności polega na tym, że zwiększa ona zakres Paal-Knorra, wykorzystując bogactwo chemii acetylenu, która istnieje, szczególnie do wytwarzania alkoholi propargilowych.
Acetale
Acetale okazały się również użytecznymi materiałami wyjściowymi dla Paal-Knorra. Keton z oddalonymi od niego wiązaniami acetalowymi 3 może być przekształcony w dokładnie takich samych warunkach jak 1,4-diketon w odpowiedni heterocykl.
Wspomagany mikrofalowo Paal-Knorr
Inną odmianą było wprowadzenie promieniowania mikrofalowego w celu wzmocnienia Paala-Knorra. Tradycyjne warunki Paala-Knorra obejmowały przedłużone ogrzewanie mocnych kwasów w celu wywołania odwodnienia, które występowało w ciągu kilku godzin. Wykazano, że reakcje Paala-Knorra wspomagane mikrofalami występują w skalach czasowych mierzonych w minutach oraz w otwartych kolbach w temperaturze pokojowej.
Powiązane reakcje
Knorr pirolo syntezy , podano Knorr 1884 jest synteza podstawionego pirolu z amino-ketonu i ketonu.
| Synteza pirazolu Knorra | |
|---|---|
| Nazwany po | Ludwig Knorra |
| Typ reakcji | Reakcja tworząca pierścień |
| Identyfikatory | |
| Identyfikator ontologii RSC | Numer RX:0000391 |
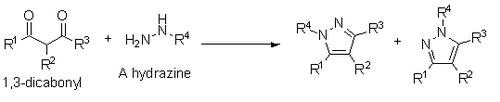
Knorr donosi również o syntezie pirazoli z 1,3-dikarbonyli i hydrazyn , hydrazydów lub semibikarbazydów. Synteza ta zachodzi poprzez mechanizm kondensacji podobny do Paala-Knorra, jednak jeśli stosuje się podstawioną hydrazynę, daje w wyniku mieszaninę regioizomerów, w której podstawiony heteroatom znajduje się albo obok podstawnika R1 albo podstawnika R3.
Aplikacje syntetyczne
W 2000 roku BM Trost i in. donieśli o formalnej syntezie antybiotyku roseofiliny. Droga Trosta do makrocyklicznego rdzenia roseofiliny, podobnie jak inne, opierała się na syntezie Paala-Knorra Pyrrole w celu uzyskania skondensowanego pirolu. Ogrzewanie 1,4-diketonu z octanem amonu w metanolu z kwasem kamforosulfonowym i sitami molekularnymi o długości 4 angstremów dało pirol bez podstawienia N. Stwierdzono, że ten pirol jest nietrwały i jako taki potraktowano chlorkiem trimetylosililoetoksymetoksy (SEM-Cl) w celu ochrony pirolu przed wyodrębnieniem.
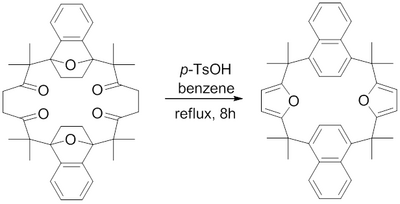
W 1982 roku H. Hart i in. opisał syntezę makrocyklu zawierającego skondensowane pierścienie furanowe przy użyciu syntezy furanowej Paala-Knorra. Ogrzewanie w temperaturze wrzenia p -toluenosulfonowy kwas w benzenie stwierdzono odwodnić 1,4-diketonów do ich furanów osiągnąć trudnych makrocyklicznych skondensowane furanów.
Zobacz też
- Synteza pirolu Hantzscha
- Synteza pirolu Knorra
- Synteza Feista-Benary
- Cyklizacja Volharda-Erdmanna
- Synteza pirydyny Hantzscha