Przetwarzanie obrazów medycznych - Medical image computing
Medical image computing (MIC) to interdyscyplinarna dziedzina z pogranicza informatyki , inżynierii informacyjnej , elektrotechniki , fizyki , matematyki i medycyny . Dziedzina ta rozwija metody obliczeniowe i matematyczne do rozwiązywania problemów dotyczących obrazów medycznych i ich wykorzystania w badaniach biomedycznych i opiece klinicznej.
Głównym celem MIC jest wyodrębnienie istotnych klinicznie informacji lub wiedzy z obrazów medycznych. Chociaż MIC jest blisko związany z dziedziną obrazowania medycznego , MIC skupia się na analizie obliczeniowej obrazów, a nie na ich akwizycji. Metody te można podzielić na kilka ogólnych kategorii: segmentacji obrazu , rejestracji obrazu , obraz oparty na modelowaniu fizjologiczne i inne.
Formularze danych
Przetwarzanie obrazów medycznych zazwyczaj działa na danych próbkowanych jednolicie z regularnymi odstępami przestrzennymi xyz (obrazy w 2D i objętości w 3D, ogólnie nazywane obrazami). W każdym punkcie próbkowania dane są zwykle reprezentowane w postaci integralnej, takiej jak podpisana i unsigned short (16-bitowa), chociaż formy od unsigned char (8-bitowe) do 32-bitowej liczby zmiennoprzecinkowej nie są rzadkością. Szczególne znaczenie danych w punkcie próbkowania zależy od modalności: na przykład akwizycja CT zbiera wartości gęstości promieniotwórczej, podczas gdy akwizycja MRI może zbierać obrazy T1 lub T2- ważone. Wzdłużne, zmienne w czasie akwizycje mogą, ale nie muszą, pozyskiwać obrazy w regularnych odstępach czasu. Obrazy podobne do wachlarza ze względu na modalności, takie jak ultrasonografia z zakrzywioną matrycą, są również powszechne i wymagają różnych technik reprezentacyjnych i algorytmicznych do przetwarzania. Inne formularze danych obejmują obrazy ścięte z powodu nachylenia gantry podczas akwizycji; oraz siatki niestrukturalne , takie jak formy sześciościenne i czworościenne, które są wykorzystywane w zaawansowanych analizach biomechanicznych (np. deformacje tkanek, transport naczyniowy, implanty kostne).
Segmentacja
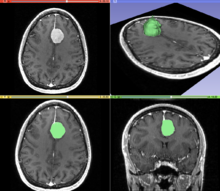
Segmentacja to proces podziału obrazu na różne znaczące segmenty. W obrazowaniu medycznym segmenty te często odpowiadają różnym klasom tkanek, narządom , patologiom lub innym biologicznie istotnym strukturom. Segmentację obrazu medycznego utrudnia niski kontrast, szum i inne niejasności obrazowania. Chociaż istnieje wiele technik widzenia komputerowego do segmentacji obrazów , niektóre z nich zostały specjalnie przystosowane do przetwarzania obrazów medycznych. Poniżej znajduje się próbka technik z tej dziedziny; wdrożenie opiera się na wiedzy, którą mogą zapewnić klinicyści.
- Segmentacja oparta na Atlasie : W wielu zastosowaniach ekspert kliniczny może ręcznie oznaczyć kilka obrazów; segmentacja niewidocznych obrazów jest kwestią ekstrapolacji z tych ręcznie oznaczonych obrazów szkoleniowych. Metody tego stylu są zwykle określane jako metody segmentacji oparte na atlasie. Metody atlasu parametrycznego zazwyczaj łączą te obrazy szkoleniowe w jeden obraz atlasu, podczas gdy metody atlasu nieparametrycznego zazwyczaj wykorzystują wszystkie obrazy szkoleniowe oddzielnie. Metody oparte na atlasie zwykle wymagają użycia rejestracji obrazu w celu wyrównania obrazu lub obrazów atlasu do nowego, niewidocznego obrazu.
- Segmentacja oparta na kształcie : wiele metod parametryzuje kształt szablonu dla danej struktury, często opierając się na punktach kontrolnych wzdłuż granicy. Cały kształt jest następnie deformowany, aby pasował do nowego obrazu. Dwie z najpopularniejszych technik opartych na kształtach to modele aktywnych kształtów i modele aktywnego wyglądu. Metody te były bardzo wpływowe i dały początek podobnym modelom.
- Segmentacja oparta na obrazie : niektóre metody inicjują szablon i poprawiają jego kształt zgodnie z danymi obrazu, jednocześnie minimalizując miary błędów integralnych, takich jak model aktywnego konturu i jego odmiany.
- Segmentacja interaktywna : metody interaktywne są przydatne, gdy lekarze mogą dostarczyć pewnych informacji, takich jak obszar zarodkowy lub przybliżony zarys obszaru do segmentacji. Algorytm może następnie iteracyjnie udoskonalić taką segmentację, z pomocą lub bez wskazówek lekarza. Segmentacja ręczna, wykorzystująca narzędzia, takie jak pędzel, w celu wyraźnego zdefiniowania klasy tkanki każdego piksela, pozostaje złotym standardem w wielu zastosowaniach do obrazowania. Ostatnio do segmentacji włączono zasady teorii sterowania ze sprzężeniem zwrotnym , co daje użytkownikowi znacznie większą elastyczność i pozwala na automatyczną korektę błędów.
- Subiektywna segmentacja powierzchni: Metoda ta opiera się na idei ewolucji funkcji segmentacji, która rządzi się modelem adwekcyjno-dyfuzyjnym. Do segmentacji obiektu potrzebny jest ziarno segmentacji (czyli punkt początkowy, który określa przybliżoną pozycję obiektu na obrazie). W konsekwencji konstruowana jest początkowa funkcja segmentacji. Ideą subiektywnej metody powierzchniowej jest to, że pozycja nasion jest głównym czynnikiem determinującym formę tej funkcji segmentacji.
Istnieje jednak inna klasyfikacja metod segmentacji obrazu, które są podobne do powyższych kategorii. Ponadto możemy zaklasyfikować inną grupę jako „Hybrydową”, która opiera się na kombinacji metod.
Rejestracja
Rejestracja obrazu to proces polegający na wyszukiwaniu prawidłowego wyrównania obrazów. W najprostszym przypadku dwa obrazy są wyrównane. Zazwyczaj jeden obraz jest traktowany jako obraz docelowy, a drugi jako obraz źródłowy; obraz źródłowy jest przekształcany w celu dopasowania do obrazu docelowego. Procedura optymalizacji aktualizuje przekształcenie obrazu źródłowego na podstawie wartości podobieństwa, która ocenia bieżącą jakość wyrównania. Ta iteracyjna procedura jest powtarzana aż do znalezienia (lokalnego) optimum. Przykładem jest rejestracja obrazów CT i PET w celu połączenia informacji strukturalnych i metabolicznych (patrz rysunek).
Rejestracja obrazu jest wykorzystywana w różnych zastosowaniach medycznych:
- Badanie zmian czasowych. Badania podłużne pozyskują obrazy w ciągu kilku miesięcy lub lat w celu zbadania procesów długoterminowych, takich jak progresja choroby. Serie czasowe odpowiadają obrazom uzyskanym w ramach tej samej sesji (sekundy lub minuty). Mogą być wykorzystywane do badania procesów poznawczych, deformacji serca i oddychania.
- Łączenie uzupełniających się informacji z różnych metod obrazowania . Przykładem jest połączenie informacji anatomicznych i funkcjonalnych. Ponieważ wielkość i kształt struktur różnią się w zależności od modalności, trudniej jest ocenić jakość wyrównania. Doprowadziło to do stosowania środków podobieństwa, takich jak wzajemne informowanie .
- Charakterystyka populacji podmiotów. W przeciwieństwie do rejestracji wewnątrzosobniczej, mapowanie jeden do jednego może nie istnieć między osobnikami, w zależności od strukturalnej zmienności narządu będącego przedmiotem zainteresowania. Do budowy atlasu w anatomii obliczeniowej wymagana jest rejestracja międzyprzedmiotowa . Tutaj celem jest statystyczne modelowanie anatomii narządów u badanych.
- Chirurgia wspomagana komputerowo . W chirurgii wspomaganej komputerowo obrazy przedoperacyjne, takie jak CT lub MRI, są rejestrowane w obrazach śródoperacyjnych lub systemach śledzenia w celu ułatwienia prowadzenia obrazu lub nawigacji.
Podczas rejestracji obrazu należy wziąć pod uwagę kilka ważnych kwestii:
- Model transformacji . Typowymi wyborami są modele transformacji sztywne , afiniczne i odkształcalne . Modele splajnowe typu B-sklejane i modele cienkopłytkowe są powszechnie używane do sparametryzowanych pól transformacji. Nieparametryczne lub gęste pola deformacji przenoszą wektor przemieszczenia w każdym miejscu siatki; wymaga to dodatkowych ograniczeń regularyzacyjnych . Specyficzną klasą pól deformacyjnych są dyfeomorfizmy , które są transformacjami odwracalnymi z gładką odwrotnością.
- Miernik podobieństwa. Do ilościowego określenia jakości rejestracji wykorzystuje się funkcję odległości lub podobieństwa. To podobieństwo można obliczyć na oryginalnych obrazach lub na cechach wyodrębnionych z obrazów. Wspólne miary podobieństwa to suma kwadratów odległości (SSD), współczynnik korelacji i wzajemne informacje . Wybór miary podobieństwa zależy od tego, czy obrazy pochodzą z tej samej modalności; szum akwizycji może również odgrywać rolę w tej decyzji. Na przykład dysk SSD jest optymalną miarą podobieństwa obrazów o tej samej modalności z szumem gaussowskim . Jednak statystyki obrazu w ultradźwiękach znacznie różnią się od szumu Gaussa, co prowadzi do wprowadzenia specyficznych dla ultradźwięków miar podobieństwa. Rejestracja multimodalna wymaga bardziej wyrafinowanego środka podobieństwa; alternatywnie można zastosować inną reprezentację obrazu, taką jak reprezentacje strukturalne lub rejestracja sąsiedniej anatomii.
- Procedura optymalizacji . Albo ciągły lub dyskretny optymalizacja jest wykonywana. W przypadku optymalizacji ciągłej stosuje się techniki optymalizacji oparte na gradientach w celu poprawy szybkości zbieżności.
Wyobrażanie sobie
Wizualizacja odgrywa kilka kluczowych ról w Medical Image Computing. Metody wizualizacji naukowej służą do zrozumienia i komunikowania obrazów medycznych, które są z natury przestrzenno-czasowe. Wizualizacja danych i analiza danych są wykorzystywane na nieustrukturyzowanych formularzach danych , na przykład podczas oceny miar statystycznych uzyskanych podczas przetwarzania algorytmicznego. Bezpośrednia interakcja z danymi, kluczowa funkcja procesu wizualizacji, służy do wykonywania wizualnych zapytań o dane, opisywania obrazów, prowadzenia procesów segmentacji i rejestracji oraz kontrolowania wizualnej reprezentacji danych (poprzez kontrolowanie właściwości renderowania oświetlenia i parametrów wyświetlania). Wizualizacja jest wykorzystywana zarówno do wstępnej eksploracji, jak i do przekazywania pośrednich i końcowych wyników analiz.
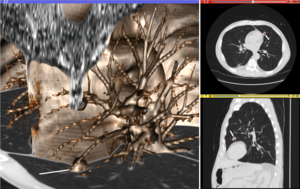
Rysunek „Wizualizacja obrazowania medycznego” ilustruje kilka rodzajów wizualizacji: 1. wyświetlanie przekrojów jako obrazów w skali szarości; 2. przeformatowane widoki obrazów w skali szarości (widok strzałkowy w tym przykładzie ma inną orientację niż pierwotny kierunek akwizycji obrazu; oraz 3. 3D renderowanie objętości tych samych danych. Zmiana guzkowa jest wyraźnie widoczna w różnych prezentacjach i został oznaczony białą linią.
Atlasy
Obrazy medyczne mogą się znacznie różnić u poszczególnych osób, ponieważ ludzie mają narządy o różnych kształtach i rozmiarach. Dlatego reprezentowanie obrazów medycznych w celu uwzględnienia tej zmienności ma kluczowe znaczenie. Popularnym podejściem do przedstawiania obrazów medycznych jest użycie jednego lub więcej atlasów. W tym przypadku atlas odnosi się do określonego modelu populacji obrazów z parametrami, które są wyuczone z zestawu danych treningowych.
Najprostszym przykładem atlasu jest obraz o średniej intensywności, powszechnie nazywany szablonem. Jednak atlas może również zawierać bogatsze informacje, takie jak lokalne statystyki obrazu i prawdopodobieństwo, że dana lokalizacja przestrzenna ma określoną etykietę. Nowe obrazy medyczne, które nie są wykorzystywane podczas szkolenia, można odwzorować w atlasie, który został dostosowany do konkretnego zastosowania, takiego jak segmentacja i analiza grupowa . Mapowanie obrazu do atlasu zwykle wiąże się z zarejestrowaniem obrazu i atlasu. Ta deformacja może być wykorzystana do rozwiązania problemu zmienności obrazów medycznych.
Pojedynczy szablon
Najprostszym podejściem jest modelowanie obrazów medycznych jako zdeformowanych wersji pojedynczego obrazu szablonu. Na przykład, anatomiczne skany mózgu MRI są często mapowane do szablonu MNI, aby reprezentować wszystkie skany mózgu we wspólnych współrzędnych. Główną wadą podejścia opartego na jednym szablonie jest to, że jeśli istnieją znaczące różnice między szablonem a danym obrazem testowym, może nie być dobrego sposobu na zmapowanie jednego z drugim. Na przykład anatomiczny skan mózgu MRI pacjenta z poważnymi nieprawidłowościami mózgu (tj. guzem lub zabiegiem chirurgicznym) może nie być łatwo mapowany do szablonu MNI.
Wiele szablonów
Zamiast polegać na jednym szablonie, można użyć wielu szablonów. Pomysł polega na przedstawieniu obrazu jako zdeformowanej wersji jednego z szablonów. Na przykład może istnieć jeden szablon dla zdrowej populacji i jeden szablon dla chorej populacji. Jednak w wielu aplikacjach nie jest jasne, ile szablonów jest potrzebnych. Prostym, aczkolwiek kosztownym obliczeniowo sposobem radzenia sobie z tym problemem, jest ustawienie każdego obrazu w uczącym zestawie danych jako obrazu szablonu, a zatem każdy nowy napotkany obraz jest porównywany z każdym obrazem w uczącym zestawie danych. Nowsze podejście automatycznie wyszukuje liczbę potrzebnych szablonów.
Analiza statystyczna
Metody statystyczne łączą dziedzinę obrazowania medycznego z nowoczesnym widzeniem komputerowym , uczeniem maszynowym i rozpoznawaniem wzorców . W ciągu ostatniej dekady udostępniono publicznie kilka dużych zbiorów danych (patrz na przykład ADNI, 1000 funkcjonalnych Connectomes Project), częściowo dzięki współpracy między różnymi instytutami i ośrodkami badawczymi. Ten wzrost rozmiaru danych wymaga nowych algorytmów, które potrafią eksplorować i wykrywać subtelne zmiany w obrazach, aby odpowiedzieć na pytania kliniczne. Takie pytania kliniczne są bardzo zróżnicowane i obejmują analizę grupową, biomarkery obrazowania, fenotypowanie choroby i badania podłużne.
Analiza grupowa
W analizie grupowej celem jest wykrycie i kwantyfikacja nieprawidłowości wywołanych przez chorobę poprzez porównanie obrazów dwóch lub więcej kohort. Zwykle jedna z tych kohort składa się z normalnych (kontrolnych) osobników, a druga składa się z pacjentów nienormalnych. Zmienność spowodowana chorobą może objawiać się nieprawidłową deformacją anatomii (patrz morfometria oparta na wokselu ). Na przykład kurczenie się tkanek podkorowych, takich jak hipokamp w mózgu, może być związane z chorobą Alzheimera . Dodatkowo zmiany w aktywności biochemicznej (funkcjonalnej) można zaobserwować za pomocą metod obrazowania, takich jak pozytonowa tomografia emisyjna .
Porównanie między grupami odbywa się zwykle na poziomie wokseli . W związku z tym najpopularniejszy potok przetwarzania wstępnego, szczególnie w neuroobrazowaniu , przekształca wszystkie obrazy w zbiorze danych do wspólnej ramki współrzędnych za pośrednictwem ( rejestracja obrazów medycznych ), aby zachować zgodność między wokselami. Biorąc pod uwagę tę zależność wokseli, najczęstszą metodą częstych jest wyodrębnienie statystyk dla każdego woksela (na przykład średnie natężenie wokseli dla każdej grupy) i wykonanie statystycznego testowania hipotez w celu oceny, czy hipoteza zerowa jest poparta, czy nie. Hipoteza zerowa zazwyczaj zakłada, że dwie kohorty pochodzą z tego samego rozkładu, a zatem powinny mieć te same właściwości statystyczne (na przykład średnie wartości dwóch grup są równe dla konkretnego woksela). Ponieważ obrazy medyczne zawierają dużą liczbę wokseli, należy zająć się kwestią wielokrotnych porównań . Istnieją również podejścia bayesowskie do rozwiązywania problemu analizy grupowej.
Klasyfikacja
Chociaż analiza grupowa może ilościowo określić ogólny wpływ patologii na anatomię i funkcję, nie zapewnia pomiarów na poziomie podmiotu, a zatem nie może być wykorzystana jako biomarkery do diagnozy (patrz Biomarkery obrazowania). Z drugiej strony klinicyści są często zainteresowani wczesną diagnozą patologii (tj. klasyfikacją) oraz poznaniem progresji choroby (tj. regresji). Z metodologicznego punktu widzenia obecne techniki różnią się od stosowania standardowych algorytmów uczenia maszynowego do zestawów danych obrazowania medycznego (np. maszyna wektorów wsparcia ) po opracowywanie nowych podejść dostosowanych do potrzeb danej dziedziny. Główne trudności są następujące:
- Mały rozmiar próbki ( Curse of Dimensionality ): duży zestaw danych obrazowania medycznego zawiera setki do tysięcy obrazów, podczas gdy liczba wokseli w typowym obrazie wolumetrycznym może z łatwością przekroczyć miliony. Rozwiązaniem tego problemu jest zmniejszenie liczby cech w sensie informacyjnym (patrz redukcja wymiarowości ). Zaproponowano kilka nienadzorowanych i częściowo/nadzorowanych podejść do rozwiązania tego problemu.
- Interpretowalność: Dobra dokładność uogólnienia nie zawsze jest głównym celem, ponieważ klinicyści chcieliby zrozumieć, które części anatomii są dotknięte chorobą. Dlatego bardzo ważna jest interpretacja wyników; metody, które ignorują strukturę obrazu, nie są preferowane. Zaproponowano alternatywne metody oparte na doborze cech .
Grupowanie
Metody klasyfikacji wzorców oparte na obrazach zazwyczaj zakładają, że neurologiczne skutki choroby są wyraźne i dobrze zdefiniowane. Nie zawsze tak jest. W przypadku szeregu schorzeń populacje pacjentów są wysoce niejednorodne i nie ustalono dalszej kategoryzacji na warunki podrzędne. Dodatkowo, niektóre choroby (np. zaburzenia ze spektrum autyzmu (ASD), schizofrenia , łagodne zaburzenia poznawcze (MCI)) mogą charakteryzować się ciągłymi lub prawie ciągłymi widmami od łagodnych zaburzeń poznawczych do bardzo wyraźnych zmian patologicznych. Aby ułatwić opartą na obrazie analizę zaburzeń heterogenicznych, opracowano metodologiczne alternatywy dla klasyfikacji wzorców. Techniki te zapożyczają idee z wielowymiarowego grupowania i wielowymiarowej regresji wzorców, aby zgrupować daną populację w jednorodne subpopulacje. Celem jest zapewnienie lepszego ilościowego zrozumienia choroby w każdej subpopulacji.
Analiza kształtu
Analiza kształtu to dziedzina Medical Image Computing, która bada właściwości geometryczne struktur uzyskanych z różnych modalności obrazowania . Analiza kształtu w ostatnim czasie cieszy się coraz większym zainteresowaniem środowiska medycznego ze względu na jej potencjał do precyzyjnej lokalizacji zmian morfologicznych między różnymi populacjami struktur, tj. zdrowymi a patologicznymi, kobietami a mężczyznami, młodymi a starszymi. Analiza kształtu obejmuje dwa główne etapy: zgodność kształtu i analizę statystyczną.
- Korespondencja kształtów to metodologia obliczania odpowiednich lokalizacji między kształtami geometrycznymi reprezentowanymi przez siatki trójkątów, kontury, zbiory punktów lub obrazy wolumetryczne. Oczywiście definicja korespondencji będzie miała bezpośredni wpływ na analizę. Wśród różnych opcji ram korespondencji możemy znaleźć: korespondencję anatomiczną, ręczne punkty orientacyjne, korespondencję funkcjonalną (tj. w locus morfometrii mózgu odpowiedzialnego za tę samą funkcjonalność neuronów), korespondencję geometryczną, (dla objętości obrazów) podobieństwo intensywności itp. Niektóre podejścia, np. spektralne analizy kształtu, nie wymagają korespondencji, ale bezpośrednio porównują deskryptory kształtu.
- Analiza statystyczna zapewni pomiary zmian strukturalnych w odpowiednich lokalizacjach.
Studia podłużne
W badaniach podłużnych ta sama osoba jest wielokrotnie obrazowana. Informacje te można włączyć zarówno do analizy obrazu , jak i do modelowania statystycznego.
- W podłużnym przetwarzaniu obrazu metody segmentacji i analizy poszczególnych punktów czasowych są informowane i uregulowane za pomocą wspólnych informacji, zwykle z szablonu wewnątrzobiektowego. Ta regularyzacja ma na celu zmniejszenie szumu pomiarowego, a tym samym pomaga zwiększyć czułość i moc statystyczną. Jednocześnie należy unikać nadmiernej regulacji, aby rozmiary efektów pozostały stabilne. Na przykład intensywna regularyzacja może prowadzić do doskonałej wiarygodności testu-retestu, ale ogranicza możliwość wykrycia prawdziwych zmian i różnic między grupami. Często trzeba dążyć do kompromisu, który optymalizuje redukcję hałasu kosztem ograniczonej utraty wielkości efektu. Innym powszechnym wyzwaniem w podłużnym przetwarzaniu obrazu jest, często niezamierzone, wprowadzenie błędu przetwarzania. Gdy na przykład obrazy kontrolne są rejestrowane i ponownie próbkowane do obrazu bazowego, artefakty interpolacji są wprowadzane tylko do obrazów kontrolnych, a nie do obrazu bazowego. Artefakty te mogą powodować fałszywe efekty (zwykle skłonność do przeszacowania zmian podłużnych, a tym samym niedoszacowania wymaganej wielkości próby). Dlatego ważne jest, aby wszystkie punkty czasowe były traktowane dokładnie tak samo, aby uniknąć błędu przetwarzania.
- Przetwarzanie końcowe i analiza statystyczna danych podłużnych zwykle wymagają dedykowanych narzędzi statystycznych, takich jak ANOVA z powtarzanymi pomiarami lub bardziej wydajne liniowe modele efektów mieszanych. Dodatkowo korzystne jest uwzględnienie przestrzennego rozkładu sygnału. Na przykład, pomiary grubości kory pokażą korelację wewnątrz osobnika w czasie, a także w sąsiedztwie na powierzchni korowej - fakt, który można wykorzystać do zwiększenia mocy statystycznej. Co więcej, analiza czasu do zdarzenia (inaczej przeżycie) jest często wykorzystywana do analizy danych podłużnych i określenia istotnych predyktorów.
Modelowanie fizjologiczne oparte na obrazach
Tradycyjnie, przetwarzanie obrazów medycznych zajmowało się kwantyfikacją i łączeniem informacji strukturalnych lub funkcjonalnych dostępnych w momencie i czasie pozyskiwania obrazu. W związku z tym można to postrzegać jako ilościowe wykrywanie podstawowych procesów anatomicznych, fizycznych lub fizjologicznych. Jednak w ciągu ostatnich kilku lat rośnie zainteresowanie predykcyjną oceną choroby lub przebiegu terapii. Modelowanie oparte na obrazach, czy to o charakterze biomechanicznym, czy fizjologicznym, może zatem rozszerzyć możliwości przetwarzania obrazu z kąta opisowego na predykcyjny.
Zgodnie z planem badawczym STEP Wirtualny Fizjologiczny Człowiek (VPH) to metodologiczna i technologiczna struktura, która po ustanowieniu umożliwi badanie ludzkiego ciała jako jednego złożonego systemu. Zgodnie z koncepcją VPH, Międzynarodowa Unia Nauk Fizjologicznych (IUPS) od ponad dekady sponsoruje projekt IUPS Physiome . Jest to ogólnoświatowy wysiłek domeny publicznej mający na celu zapewnienie ram obliczeniowych dla zrozumienia fizjologii człowieka. Jego celem jest opracowanie modeli integracyjnych na wszystkich poziomach organizacji biologicznej, od genów do całych organizmów poprzez sieci regulatorowe genów, szlaki białkowe, integracyjne funkcje komórek oraz relacje struktury/funkcji tkanek i całych narządów. Takie podejście ma na celu przekształcenie obecnej praktyki w medycynie i zapoczątkowuje nową erę medycyny obliczeniowej.
W tym kontekście obrazowanie medyczne i przetwarzanie obrazów odgrywają coraz większą rolę, ponieważ dostarczają systemów i metod obrazowania, określania ilościowego i łączenia zarówno strukturalnych, jak i funkcjonalnych informacji o człowieku in vivo. Te dwa szerokie obszary badawcze obejmują transformację generycznych modeli obliczeniowych w celu reprezentowania określonych tematów, torując w ten sposób drogę dla spersonalizowanych modeli obliczeniowych. Indywidualizacja generycznych modeli obliczeniowych poprzez obrazowanie może być realizowana w trzech uzupełniających się kierunkach:
- definicja przedmiotowej domeny obliczeniowej (anatomia) i powiązanych poddomen (typy tkanek);
- zdefiniowanie warunków brzegowych i początkowych z obrazowania (dynamicznego i/lub funkcjonalnego); oraz
- charakterystyka właściwości strukturalnych i funkcjonalnych tkanek.
Ponadto obrazowanie odgrywa również kluczową rolę w ocenie i walidacji takich modeli zarówno u ludzi, jak i w modelach zwierzęcych, a także w przekładaniu modeli na warunki kliniczne, zarówno w zastosowaniach diagnostycznych, jak i terapeutycznych. W tym konkretnym kontekście obrazowanie molekularne, biologiczne i przedkliniczne zapewnia dodatkowe dane i zrozumienie podstawowej struktury i funkcji w cząsteczkach, komórkach, tkankach i modelach zwierzęcych, które można w stosownych przypadkach przenieść na fizjologię człowieka.
Zastosowania opartych na obrazie modeli VPH/Physiome w domenach podstawowych i klinicznych są szerokie. Ogólnie rzecz biorąc, obiecują, że staną się nowymi technikami obrazowania wirtualnego . Skutecznie więcej, często nieobserwowalnych, parametrów będzie obrazowanych in silico w oparciu o integrację obserwowalnych, ale czasami rzadkich i niespójnych obrazów multimodalnych i pomiarów fizjologicznych. Modele obliczeniowe posłużą do interpretacji pomiarów w sposób zgodny z podstawowymi prawami biofizycznymi, biochemicznymi lub biologicznymi badanych procesów fizjologicznych lub patofizjologicznych. Ostatecznie takie narzędzia i systemy badawcze pomogą w zrozumieniu procesów chorobowych, naturalnej historii ewolucji choroby oraz wpływu farmakologicznych i/lub interwencyjnych procedur terapeutycznych na przebieg choroby.
Wzajemne przenikanie się obrazowania i modelowania wykracza poza interpretację pomiarów w sposób zgodny z fizjologią. Modelowanie specyficzne dla pacjenta oparte na obrazach, w połączeniu z modelami urządzeń medycznych i terapiami farmakologicznymi, otwiera drogę do obrazowania predykcyjnego, dzięki któremu będzie można zrozumieć, zaplanować i zoptymalizować takie interwencje in silico .
Metody matematyczne w obrazowaniu medycznym
W obrazowaniu medycznym pojawiło się wiele wyrafinowanych metod matematycznych, które zostały już zaimplementowane w różnych pakietach oprogramowania. Obejmują one podejścia oparte na cząstkowych równaniach różniczkowych (PDE) i przepływach opartych na krzywiźnie w celu wzmocnienia, segmentacji i rejestracji. Ponieważ wykorzystują PDE, metody są podatne na zrównoleglenie i implementację na GPGPU. Wiele z tych technik zostało zainspirowanych pomysłami zapewniającymi optymalną kontrolę . W związku z tym bardzo niedawno idee z kontroli pojawiły się ostatnio w metodach interaktywnych, zwłaszcza segmentacji. Co więcej, ze względu na szum i potrzebę stosowania technik estymacji statystycznej dla bardziej dynamicznie zmieniającego się obrazowania, do użytku weszły filtr Kalmana i filtr cząstek . Przegląd tych metod wraz z obszerną listą odniesień można znaleźć w.
Obliczenia specyficzne dla modalności
Niektóre metody obrazowania dostarczają bardzo wyspecjalizowanych informacji. Uzyskane obrazy nie mogą być traktowane jako zwykłe obrazy skalarne i dają początek nowym podobszarom Medical Image Computing. Przykłady obejmują dyfuzyjny MRI , funkcjonalny MRI i inne.
Dyfuzyjny rezonans magnetyczny
Dyfuzyjny MRI to technika obrazowania strukturalnego rezonansu magnetycznego , która umożliwia pomiar procesu dyfuzji cząsteczek. Dyfuzję mierzy się przez przyłożenie impulsu gradientu do pola magnetycznego w określonym kierunku. W typowej akwizycji zestaw równomiernie rozłożonych kierunków gradientu jest używany do utworzenia zestawu objętości ważonych dyfuzją. Ponadto, w tym samym polu magnetycznym, bez zastosowania impulsu gradientu, uzyskuje się nieważoną objętość. Ponieważ każda akwizycja jest związana z wieloma objętościami, rezonans dyfuzyjny stworzył wiele unikalnych wyzwań w przetwarzaniu obrazów medycznych.
W medycynie istnieją dwa główne cele obliczeniowe dyfuzyjnego MRI :
- Szacowanie lokalnych właściwości tkanek, takich jak dyfuzyjność;
- Estymacja lokalnych kierunków i globalnych dróg dyfuzji.
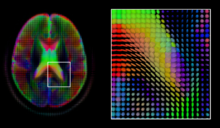
Tensora dyfuzji , 3 x 3 symetryczny określoność formy , oferuje proste rozwiązanie do obu tych celów. Jest proporcjonalna do macierzy kowariancji profilu dyfuzji lokalnej o rozkładzie normalnym, a zatem dominującym wektorem własnym tej macierzy jest główny kierunek dyfuzji lokalnej. Ze względu na prostotę tego modelu, oszacowanie maksymalnego prawdopodobieństwa tensora dyfuzji można znaleźć po prostu rozwiązując układ równań liniowych w każdej lokalizacji niezależnie. Jednakże, ponieważ zakłada się, że objętość zawiera przylegające włókna tkanki, może być korzystne oszacowanie całkowitej objętości tensorów dyfuzji przez nałożenie warunków regularności na leżące poniżej pole tensorów. Wartości skalarne można wyekstrahować z tensora dyfuzji, takie jak anizotropia frakcyjna , średnie, osiowe i promieniowe dyfuzje, które pośrednio mierzą właściwości tkanek, takie jak dysmielinizacja włókien aksonalnych lub obecność obrzęku. Standardowe metody obliczania obrazów skalarnych, takie jak rejestracja i segmentacja, mogą być stosowane bezpośrednio do wolumenów takich wartości skalarnych. Jednakże, aby w pełni wykorzystać informacje zawarte w tensorze dyfuzji, metody te zostały dostosowane do uwzględniania objętości wycenianych przez tensor podczas wykonywania rejestracji i segmentacji.
Biorąc pod uwagę główny kierunek dyfuzji w każdym miejscu w objętości, możliwe jest oszacowanie globalnych ścieżek dyfuzji za pomocą procesu znanego jako traktografia . Jednak ze względu na stosunkowo niską rozdzielczość dyfuzyjnego MRI , wiele z tych ścieżek może krzyżować się, całować lub wachlarzować w jednym miejscu. W tej sytuacji pojedynczy główny kierunek tensora dyfuzji nie jest odpowiednim modelem dla lokalnego rozkładu dyfuzji. Najczęstszym rozwiązaniem tego problemu jest oszacowanie wielu kierunków lokalnej dyfuzji przy użyciu bardziej złożonych modeli. Obejmują one mieszaniny tensorów dyfuzji, obrazowanie Q-ball, obrazowanie widma dyfuzji i funkcje dystrybucji orientacji włókien, które zazwyczaj wymagają akwizycji HARDI z dużą liczbą kierunków gradientu. Podobnie jak w przypadku tensora dyfuzji, objętości wyceniane w tych złożonych modelach wymagają specjalnego traktowania przy stosowaniu metod obliczeniowych obrazów, takich jak rejestracja i segmentacja.
Funkcjonalny rezonans magnetyczny
Funkcjonalne obrazowanie rezonansem magnetycznym (fMRI) to metoda obrazowania medycznego, która pośrednio mierzy aktywność nerwową poprzez obserwację lokalnej hemodynamiki lub sygnału zależnego od poziomu tlenu we krwi (BOLD). Dane fMRI oferują szereg spostrzeżeń i można je z grubsza podzielić na dwie kategorie:
- fMRI związane z zadaniem jest uzyskiwane, gdy podmiot wykonuje sekwencję określonych w czasie warunków eksperymentalnych. W eksperymentach z projektowaniem blokowym warunki są obecne przez krótkie okresy czasu (np. 10 sekund) i przeplatają się z okresami spoczynku. Eksperymenty związane ze zdarzeniami opierają się na losowej sekwencji bodźców i używają pojedynczego punktu czasowego do oznaczenia każdego stanu. Standardowym podejściem do analizy fMRI związanych z zadaniem jest ogólny model liniowy (GLM)
- fMRI w stanie spoczynku uzyskuje się przy braku jakiegokolwiek zadania eksperymentalnego. Zazwyczaj celem jest zbadanie wewnętrznej struktury sieciowej mózgu. Obserwacje poczynione podczas odpoczynku powiązano również z określonymi procesami poznawczymi, takimi jak kodowanie czy refleksja. Większość badań fMRI w stanie spoczynku skupia się na fluktuacjach niskiej częstotliwości sygnału fMRI (LF-BOLD). Najważniejsze odkrycia obejmują sieć domyślną , kompleksową parcelację korową oraz powiązanie cech sieci z parametrami behawioralnymi.
Istnieje bogaty zestaw metodologii stosowanych do analizy danych z neuroobrazowania funkcjonalnego i często nie ma zgody co do najlepszej metody. Zamiast tego badacze podchodzą do każdego problemu niezależnie i wybierają odpowiedni model/algorytm. W tym kontekście istnieje stosunkowo aktywna wymiana między neuronauką , biologią obliczeniową , statystyką i społecznościami uczenia maszynowego . Wybitne podejścia obejmują
- Masywne, jednowymiarowe podejścia, które badają poszczególne woksele w danych obrazowania pod kątem związku z warunkami eksperymentu. Podstawowym podejściem jest ogólny model liniowy (GLM)
- Podejścia oparte na wielu zmiennych i klasyfikatorach , często określane jako analiza wzorców wielowokselowych lub analiza wzorców wielowymiarowych, badają dane pod kątem globalnych i potencjalnie rozproszonych odpowiedzi na warunki eksperymentalne. Wczesne podejścia wykorzystywały maszyny wektorów nośnych (SVM) do badania reakcji na bodźce wzrokowe. Ostatnio zbadano alternatywne algorytmy rozpoznawania wzorców, takie jak losowy kontrast Gini oparty na lesie lub rzadka regresja i uczenie się słownika
- Analiza łączności funkcjonalnej bada wewnętrzną strukturę sieciową mózgu, w tym interakcje między regionami. Większość takich badań skupia się na danych o stanie spoczynku w celu podzielenia mózgu lub znalezienia korelacji z miarami behawioralnymi. Dane specyficzne dla zadania można wykorzystać do badania związków przyczynowych między regionami mózgu (np. dynamiczne mapowanie przyczynowe (DCM)).
Podczas pracy z dużymi kohortami podmiotów kluczowe znaczenie ma normalizacja (rejestracja) poszczególnych podmiotów we wspólnym układzie odniesienia. Istnieje szereg prac i narzędzi do normalizacji opartej na anatomii ( FSL , FreeSurfer , SPM ). Wyrównanie uwzględniające zmienność przestrzenną między obiektami jest nowszym kierunkiem pracy. Przykładami są wyrównanie kory oparte na korelacji sygnału fMRI, wyrównanie oparte na globalnej strukturze łączności funkcjonalnej zarówno w danych zadania, jak i stanie spoczynku, oraz wyrównanie oparte na profilach aktywacji poszczególnych wokseli specyficznych dla bodźca.
Oprogramowanie
Oprogramowanie do przetwarzania obrazu medycznego to złożona kombinacja systemów zapewniających IO, wizualizację i interakcję, interfejs użytkownika, zarządzanie danymi i obliczenia. Zazwyczaj architektury systemu są warstwowe, aby służyć programistom algorytmów, programistom aplikacji i użytkownikom. Dolne warstwy to często biblioteki i/lub zestawy narzędzi, które zapewniają podstawowe możliwości obliczeniowe; podczas gdy górne warstwy to specjalistyczne aplikacje, które dotyczą konkretnych problemów medycznych, chorób lub układów organizmu.
Dodatkowe uwagi
Medical Image Computing jest również powiązana z dziedziną widzenia komputerowego . Międzynarodowe stowarzyszenie The MICCAI Society reprezentuje tę dziedzinę i organizuje coroczną konferencję i związane z nią warsztaty. Materiały z tej konferencji są publikowane przez Springera w serii Lecture Notes in Computer Science. W 2000 roku N. Ayache i J. Duncan dokonali przeglądu stanu pola.
Zobacz też
Bibliografia
Czasopisma na temat przetwarzania obrazu medycznego
- Analiza obrazu medycznego (MedIA) ; także oficjalne czasopismo The MICCAI Society , które organizuje Doroczną Konferencję MICCAI, premierową konferencję na temat przetwarzania obrazu medycznego
- Transakcje IEEE dotyczące obrazowania medycznego (IEEE TMI)
- Fizyka medyczna
- Journal of Digital Imaging (JDI) ; oficjalne czasopismo Towarzystwa Informatyki Obrazowej
- Komputerowe obrazowanie medyczne i grafika
- Journal of Computer Aided Radiology and Surgery
- Obrazowanie medyczne BMC
Ponadto w następujących czasopismach od czasu do czasu publikowane są artykuły opisujące metody i konkretne zastosowania kliniczne przetwarzania obrazu medycznego lub przetwarzania obrazu medycznego specyficznego dla modalności