Testy na obecność antygenu malarii - Malaria antigen detection tests
| Testy wykrywania antygenu malarii | |
|---|---|
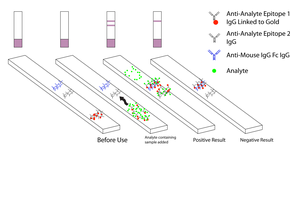 Schematyczny diagram miarki
| |
| Cel, powód | diagnoza malarii... |
Testy na wykrycie antygenu malarii są grupą dostępnych komercyjnie szybkich testów diagnostycznych z szybkiego testu antygen typu, które umożliwiają szybką diagnozę z malarią przez ludzi, którzy nie są w inny sposób specjalistom w tradycyjnych technikach laboratoryjnych do diagnozowania malarii lub w sytuacjach, w których taki sprzęt jest niedostępny. Obecnie na rynku dostępnych jest ponad 20 takich testów (testy produktów WHO 2008). Pierwszym antygenem malarii odpowiednim jako cel do takiego testu był rozpuszczalny enzym glikolityczny, dehydrogenaza glutaminianowa . Żaden z szybkich testów nie jest obecnie tak czuły jak gruby film krwi , ani tak tani. Główną wadą w stosowaniu wszystkich obecnych metod pomiaru poziomu jest to, że wynik jest zasadniczo jakościowy. Jednak w wielu endemicznych obszarach tropikalnej Afryki ilościowa ocena parazytemii jest ważna, ponieważ duży odsetek populacji da wynik pozytywny w każdym teście jakościowym.
Szybkie testy diagnostyczne na malarię oparte na antygenach
Malaria jest chorobą uleczalną , jeśli pacjenci mają dostęp do wczesnej diagnozy i szybkiego leczenia . Szybkie testy diagnostyczne oparte na antygenach (RDT) odgrywają ważną rolę na obrzeżach możliwości służby zdrowia, ponieważ wiele wiejskich klinik nie ma możliwości diagnozowania malarii na miejscu z powodu braku mikroskopów i wyszkolonych techników do oceny rozmazów krwi. Ponadto w regionach, w których choroba nie jest endemiczna , technolodzy laboratoryjni mają bardzo ograniczone doświadczenie w wykrywaniu i identyfikacji pasożytów malarii. Co roku coraz większa liczba podróżnych z obszarów o klimacie umiarkowanym odwiedza kraje tropikalne, a wielu z nich wraca z infekcją malarią. Testy RDT są nadal uważane za uzupełnienie konwencjonalnej mikroskopii, ale z pewnymi ulepszeniami mogą z powodzeniem zastąpić mikroskop . Testy są proste, a zabieg można wykonać na miejscu w warunkach polowych. Testy te wykorzystują krew z opuszki palca lub krew żylną , ukończone badanie zajmuje łącznie 15-20 minut, a laboratorium nie jest potrzebne. Próg wykrywalności w tych szybkich testach diagnostycznych mieści się w zakresie 100 pasożytów/µl krwi w porównaniu do 5 w mikroskopie grubowarstwowym.
pGluDH
Dokładna diagnoza staje się coraz ważniejsza ze względu na rosnącą odporność Plasmodium falciparum i wysoką cenę alternatyw dla chlorochiny . Enzym pGluDH nie występuje w krwinkach czerwonych gospodarza i był zalecany jako enzym markerowy dla gatunków Plasmodium przez Picard-Maureau et al. w 1975 roku. Test enzymatyczny markera malarii nadaje się do rutynowej pracy i jest obecnie standardowym testem w większości oddziałów zajmujących się malarią. Wiadomo, że obecność pGluDH reprezentuje żywotność pasożyta, a szybki test diagnostyczny wykorzystujący pGluDH jako antygen miałby zdolność do różnicowania żywych od martwych organizmów. Kompletna RDT z pGluDH jako antygenem została opracowana w Chinach i obecnie przechodzi badania kliniczne . GluDH to wszechobecne enzymy, które zajmują ważny punkt rozgałęzienia między metabolizmem węgla i azotu. Zarówno enzymy GluDH zależne od fosforanu dinukleotydu nikotynamidoadeninowego (NAD) [EC 1.4.1.2], jak i GluDH zależne od fosforanu dinukleotydu nikotynamidoadeninowego (EC 1.4.1.4) [EC 1.4.1.4] są obecne w Plasmodia ; GluDH zależny od NAD jest stosunkowo niestabilny i nieprzydatny do celów diagnostycznych. Dehydrogenaza glutaminianowa dostarcza utlenialnego źródła węgla wykorzystywanego do produkcji energii, a także zredukowanego nośnika elektronów NADH. Glutaminian jest głównym donorem aminokwasów do innych aminokwasów w kolejnych reakcjach transaminacji. Wielorakie role glutaminianu w równowadze azotowej sprawiają, że jest to brama pomiędzy wolnym amoniakiem a grupami aminowymi większości aminokwasów. Opublikowano jego strukturę krystaliczną . Aktywność GluDH w P. vivax , P.ovale i P. malariae nie został sprawdzony, ale biorąc pod uwagę znaczenie GluDH jak enzym rozgałęzienie, każda komórka musi mieć wysokie stężenie GluDH. Powszechnie wiadomo, że enzymy o dużej masie cząsteczkowej (takie jak GluDH) mają wiele izoenzymów , co umożliwia różnicowanie szczepów (przy założeniu odpowiedniego przeciwciała monoklonalnego ). Gospodarz wytwarza przeciwciała przeciwko enzymowi pasożytniczemu, co wskazuje na niską identyczność sekwencji.
Białko bogate w histydynę II
Białko bogate w histydynę II (HRP II) to bogate w histydynę i alaninę , rozpuszczalne w wodzie białko, które jest zlokalizowane w kilku przedziałach komórkowych, w tym w cytoplazmie pasożyta. Antygen jest wyrażany tylko przez trofozoity P. falciparum . HRP II z P. falciparum jest zaangażowana w biocrystallization z hemozoin , obojętnym postaci krystalicznej ferriprotoporphyrin IX (Fe (3 +) - PpIX) wytwarzanego przez pasożyta. Znaczna ilość HRP II jest wydzielana przez pasożyta do krwiobiegu gospodarza, a antygen można wykryć w erytrocytach , surowicy , osoczu , płynie mózgowo-rdzeniowym, a nawet moczu jako wydzielane białko rozpuszczalne w wodzie. Antygeny te utrzymują się we krwi krążącej po ustąpieniu lub znacznej redukcji parazytemii. Zwykle po udanym leczeniu testy oparte na HRP2 zwykle trwają około dwóch tygodni, ale może to potrwać nawet miesiąc, co zmniejsza ich wartość w wykrywaniu aktywnej infekcji. Fałszywie dodatnie wyniki testów paskowych zgłaszano u pacjentów z reumatoidalnym zapaleniem stawów z dodatnim czynnikiem reumatoidalnym . Ponieważ HRP- 2 ulega ekspresji tylko przez P . falciparum , testy te dadzą wyniki ujemne z próbkami zawierającymi tylko P. vivax , P. ovale lub P. malariae ; wiele przypadków malarii innych niż falciparum może być zatem błędnie zdiagnozowanych jako nie malarii (niektóre szczepy P. falciparum również nie mają HRP II). Zmienność wyników RDT opartych na pHRP2 jest związana ze zmiennością antygenu docelowego.
pLDH
Dehydrogenaza mleczanowa P. falciparum (PfLDH) jest oksydoreduktazą o masie 33 kDa [EC 1.1.1.27]. Jest ostatnim enzymem szlaku glikolitycznego, niezbędnym do wytwarzania ATP i jednym z najliczniejszych enzymów wyrażanych przez P. falciparum . Plasmodium LDH (pLDH) z P. vivax , P. malariae i P. ovale ) wykazują 90-92% identyczność z PfLDH z P. falciparum . Zaobserwowano, że poziomy pLDH we krwi zmniejszają się wcześniej po leczeniu niż HRP2. Pod tym względem pLDH jest podobny do pGluDH. Niemniej jednak właściwości kinetyczne i wrażliwość na inhibitory ukierunkowane na miejsce wiązania kofaktora różnią się znacznie i można je zidentyfikować mierząc stałe dysocjacji dla inhibitorów, które różnią się nawet 21-krotnie.
pAldo
Aldolaza fruktozo-bisfosforanowa [EC 4.1.2.13] katalizuje kluczową reakcję w glikolizie i produkcji energii i jest wytwarzana przez wszystkie cztery gatunki. P. falciparum aldolazy jest białkiem 41 kDa i zawiera 61-68% podobieństwa sekwencji ze znanymi eukariotycznych aldolaz. Jej struktura krystaliczna została opublikowana. Obecność przeciwciał przeciwko p41 w surowicach dorosłych ludzi częściowo odpornych na malarię sugeruje, że p41 bierze udział w ochronnej odpowiedzi immunologicznej przeciwko pasożytowi.
Zobacz też
Bibliografia
- ^ a b c Ling IT.; Cooksley S.; Bates PA.; Hempelmann E.; Wilsona RJM. (1986). „Przeciwciała przeciwko dehydrogenazie glutaminianowej Plasmodium falciparum” (PDF) . Parazytologia . 92 (2): 313–324. doi : 10.1017/S0031182000064088 . PMID 3086819 .
- ^ B Rodriguez-Acosta Dominguez NG Aguilar I Girón ME (1998). „Charakterystyka antygenu rozpuszczalnego w dehydrogenazie glutaminianowej Plasmodium falciparum” . Braz J Med Biol Res . 31 (9): 1149–1155. doi : 10.1590/S0100-879X1998000900008 . PMID 9876282 .
- ^ a b Li Y, Ning YS, Li L, Peng DD, Dong WQ, Li M (2005). „Wytwarzanie przeciwciał monoklonalnych przeciwko dehydrogenazie glutaminianowej Plasmodium falciparum i zakładanie testu immunochromatograficznego ze złotem koloidalnym”. Di Yi Jun Yi da Xue Xue Bao = Czasopismo Akademickie Pierwszego Kolegium Medycznego PLA . 25 (4): 435–438. PMID 15837649 .
- ^ Warhurst DC, Williams JE (1996). „Biuletyn AKP nr 148. Lipiec 1996. Diagnostyka laboratoryjna malarii” . J Clin Pathol . 49 (7): 533–38. doi : 10.1136/jcp.49.7.533 . PMC 500564 . PMID 8813948 .
- ^ Moody A. (2002). „Szybkie testy diagnostyczne pasożytów malarii” . Clin Microbiol Rev . 15 (1): 66-78. doi : 10.1128/CMR.15.1.66-78.2002 . PMC 118060 . PMID 11781267 .
- ^ Murray CK, Bennett JW (2008). „Szybka diagnoza malarii” . Interdiscip Perspect Zainfekuj Dis . 2009 : 1-7. doi : 10.1155/2009/415953 . PMC 2696022 . PMID 19547702 .
- ^ Picard-Maureau A Hempelmann E Krämmer G Jackisch R Jung A (1975). "Glutathionstatus in Plasmodium vinckei parasitierten Erythrozyten in Abhängigkeit vom intraerythrozytären Entwicklungsstadium des Parasiten". Tropenmed Parasitol . 26 (4): 405–416. PMID 1216329 .
- ^ Werner C Stubbs MT Krauth-Siegel RL Klebe G (2005). „Struktura krystaliczna dehydrogenazy glutaminianowej Plasmodium falciparum, przypuszczalnego celu dla nowych leków przeciwmalarycznych”. J Mol Biol . 349 (3): 597–607. doi : 10.1016/j.jmb.2005.03.077 . PMID 15878595 .
- ^ a b Iqbal J, Sher A, Rab A (2000). „Plasmodium falciparum bogate w histydynę białko 2 oparte na immunologicznym teście diagnostycznym na malarię: reaktywność krzyżowa z czynnikami reumatoidalnymi” . J Clin Microbiol . 38 (3): 1184–1186. doi : 10.1128/JCM.38.3.1184-1186.2000 . PMC 86370 . PMID 10699018 .
- ^ Beadle C, Long GW, Weiss WR, McElroy PD, Maret SM, Oloo AJ, Hoffman SL (1994). „Rozpoznanie malarii przez wykrycie antygenu Plasmodium falciparum HRP-2 za pomocą szybkiego testu wychwytu antygenu paskowego” . Lancet . 343 (8897): 564-568. doi : 10.1016/S0140-6736(94)91520-2 . PMID 7906328 . S2CID 25450213 .
- ^ Rock EP, Marsh K, Saul AJ, Wellems TE, Taylor DW, Maloy WL, Howard RJ (1987). „Analiza porównawcza bogatych w histydynę białek Plasmodium falciparum HRP-I, HRP-II i HRP-III u pasożytów malarii różnego pochodzenia”. Parazytologia . 95 (2): 209–227. doi : 10.1017/S0031182000057681 . PMID 3320887 .
- ^ Humar A Ohrt C Harrington MA Pillai D Kain KC (1997). „Test Parasight F w porównaniu z reakcją łańcuchową polimerazy i mikroskopią w diagnostyce malarii Plasmodium falciparum u podróżnych”. Am J Trop Med Hyg . 56 (1): 44–48. doi : 10.4269/ajtmh.1997.56.44 . PMID 9063360 .
- ^ Baker J McCarthy J Gatton M Kyle DE Belizario V Luchavez J Bell D Cheng Q (2005). „Genetyczna różnorodność Plasmodium falciparum bogatego w histydynę białka 2 (PfHRP2) i jego wpływ na wydajność szybkich testów diagnostycznych opartych na PfHRP2” . J Zainfekuj Dis . 192 (5): 870-877. doi : 10.1086/432010 . PMID 16088837 .
- ^ Bzik DJ, Fox BA, Gonyer K (1993). „Ekspresja dehydrogenazy mleczanowej Plasmodium falciparum w Escherichia coli”. Mol Biochem Parasitol . 59 (1): 155–166. doi : 10.1016/0166-6851(93)90016-Q . PMID 8515777 .
- ^ Vander Jagt DL, Hunsaker LA, Heidrich JE (1981). „Częściowe oczyszczanie i charakterystyka dehydrogenazy mleczanowej z Plasmodium falciparum”. Parazytologia molekularna i biochemiczna . 4 (5–6): 255–264. doi : 10.1016/0166-6851(81)90058-X . PMID 7038478 .
- ^ Penna-Coutinho J, Cortopassi WA, Oliveira AA, Francja TC, Krettli AU (2011). „Aktywność przeciwmalaryczna potencjalnych inhibitorów enzymu dehydrogenazy mleczanowej Plasmodium falciparum wybranych w badaniach dokowania” . PLOS 1 . 6 (7): e21237. Kod Bib : 2011PLoSO...621237P . doi : 10.1371/journal.pone.0021237 . PMC 3136448 . PMID 21779323 .
- ^ Iqbal J, Siddique A, Jameel M, Hira PR (2004). „Trwałe białko bogate w histydynę 2, dehydrogenaza mleczanowa pasożyta i reaktywność antygenu panmalarycznego po usunięciu monozakażenia Plasmodium falciparum” . J Clin Microbiol . 42 (9): 4237–4241. doi : 10.1128/JCM.42.9.4237-4241.2004 . PMC 516301 . PMID 15365017 .
- ^ Brązowy WM, Yowell CA, skarb A, Vander Jagt TA, Hunsaker LA, pokład LM, Royer RE, Piper RC, Dame JB, Makler MT, Vander Jagt DL (2004). „Porównawcza analiza strukturalna i właściwości kinetyczne dehydrogenaz mleczanowych z czterech gatunków ludzkich pasożytów malarii”. Biochemia . 43 (20): 6219–6229. doi : 10.1021/bi049892w . PMID 15147206 .
- ^ Meier B, Dobeli H, Certa U (1992). „Etap-specyficzna ekspresja izoenzymów aldolazy u pasożyta malarii gryzoni Plasmodium berghei”. Mol Biochem Parasitol . 52 (1): 15–27. doi : 10.1016/0166-6851(92)90032-F . PMID 1625704 .
- ^ Knapp B Hundt E Küpper HA (1990). „Aldolaza Plasmodium falciparum: struktura genów i lokalizacja”. Mol Biochem Parasitol . 40 (1): 1–12. doi : 10.1016/0166-6851(90)90074-V . PMID 2190085 .
- ^ Kim H Certa U Dobeli H Jakob P Hol WG (1998). „Struktura krystaliczna aldolazy fruktozo-1,6-bisfosforanowej z ludzkiego pasożyta malarii Plasmodium falciparum”. Biochemia . 37 (13): 4388–96. doi : 10.1021/bi972233h . PMID 9521758 .
- ^ Srivastava IK, Schmidt M, Certa U, Dobeli H, Perrin LH (1990). „Swoistość i aktywność hamująca przeciwciał przeciwko aldolazie Plasmodium falciparum” . J Immunol . 144 (4): 1497-503. PMID 2406342 .


