Knorr syntezę chinoliny - Knorr quinoline synthesis
| Synteza chinoliny Knorr | |
|---|---|
| Nazwany po | Ludwig Knorr |
| typ reakcji | Reakcję tworzenia pierścienia |
| identyfikatory | |
| RSC ontologia ID | RXNO: 0000394 |
Syntezę chinoliny Knorr jest wewnątrzcząsteczkowej reakcji organicznej przekształcenie p-ketoanilide do 2-hydroksychinoliny , stosując kwas siarkowy . Reakcja ta została po raz pierwszy opisana przez Ludwig Knorr (1859-1921) 1886
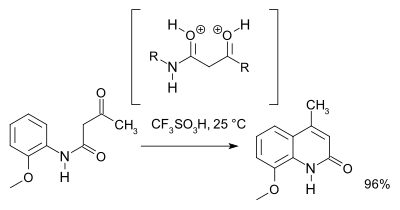
Reakcja jest rodzajem podstawienia elektrofilowego aromatycznego towarzyszy eliminacja wody. 1964 badania wykazały, że w pewnych warunkach reakcji powstawania 4-hydroksychinoliny konkurencyjna reakcja. Na przykład, benzoylacetanilide związek ( 1 ) tworzy się z 2-hydroksychinoliny ( 2 ), w dużym nadmiarze kwasu polifosforowego (PPA), ale 4-hydroksychinoliny 3 , gdy ilość PPA jest mała. Mechanizm reakcji zidentyfikowano N, O-dicationic pośredni A z nadmiarem kwasu zdolnego do zamykania pierścienia i monokationowy pośredniego B, które to fragmenty do anilinyi (ostatecznie) acetofenon . Anilina reaguje z innym równoważnika benzoylacetanilide przed utworzeniem 4-hydroksychinolinę.
Badanie 2007 zmieniony mechanizmu reakcji i na podstawie spektroskopii NMR i obliczenia teoretyczne sprzyja O, O-dicationic pośredni (a superelectrophile ) w N, O dicationic pośredniego. Do celów preparatywnych kwas trifluorometanosulfonowy zaleca się: