Syntaza ketoacylowa - Ketoacyl synthase
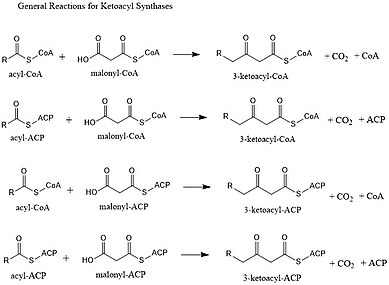
Syntazy ketoacylowe (KS) katalizują reakcję kondensacji acylo-CoA lub acylo-acylo ACP z malonylo-CoA z wytworzeniem 3-ketoacylo-CoA lub z malonylo-ACP z wytworzeniem 3-ketoacylo-ACP. Ta reakcja jest kluczowym etapem w cyklu syntezy kwasów tłuszczowych, ponieważ powstały łańcuch acylowy jest o dwa atomy węgla dłuższy niż wcześniej. KS istnieją jako pojedyncze enzymy, tak jak w syntezie kwasów tłuszczowych typu II i syntezie poliketydów typu II, lub jako domeny w dużych enzymach wielodomenowych, takich jak syntazy kwasów tłuszczowych typu I (FAS) i syntazy poliketydów (PKS). KS są podzielone na pięć rodzin: KS1, KS2, KS3, KS4 i KS5.
Systemy enzymatyczne wielodomenowe
Syntaza kwasów tłuszczowych
Syntaza kwasów tłuszczowych (FAS) to układ enzymatyczny biorący udział w syntezie kwasów tłuszczowych de novo. FAS jest iteracyjnym multienzymem składającym się z kilku składowych enzymów, z których jednym jest syntaza ketoacylowa. Istnieją dwa rodzaje FAS: typ I i typ II. FAS typu I to wysoce zintegrowane enzymy wielodomenowe. Zawierają one odrębne domeny funkcjonalne odpowiedzialne za specyficzną aktywność katalityczną sekwencji reakcji, albo na pojedynczym łańcuchu polipeptydowym, albo na dwóch różnych białkach wielofunkcyjnych. FAS typu II to systemy zdysocjowane, co oznacza, że składowe enzymy są niezależnymi białkami kodowanymi przez szereg oddzielnych genów.
Syntaza poliketydu
Syntazy poliketydowe (PKS) są strukturalnie i funkcjonalnie spokrewnione z FAS, które są enzymami katalizującymi kondensację aktywowanych pierwotnych metabolitów, takich jak acetylo-CoA i malonylo-CoA.
Główna reakcja, którą katalizują, to:
- CO 2 -CH 2 -CO-S-CoA + CH 3 -CO-S-PKS → CH 3 -CO-CH 2 -CO-S-PKS + CoA-H + CO 2
Podobnie jak FAS, PKS będą wykorzystywać β-ketoacylsyntazę (KS), opcjonalną (malonylo) acylotransferazę (MAT / AT) i fosfopantetienylowane acylowe białko nośnikowe (ACP) lub koenzym A (CoA). Obaj wykorzystali również ketoreduktazę, dehydratazę i reduktazę enoilową, aby stworzyć w pełni nasycony szkielet acylowy. Jednak w przeciwieństwie do FAS, PKS zazwyczaj wykorzystują większą liczbę biosyntetycznych bloków budulcowych i tworzą bardziej zróżnicowaną liczbę długości ogonów. Stopnie redukcyjne stosowane przez FAS są również opcjonalne dla PKS. Potencjalne pomijanie ich daje potencjał do bardziej złożonego wzorca funkcjonalizacji.
Istnieją trzy główne typy poliketydów: typ I, typ II i typ III. Typ I jest bardzo podobny do FAS typu I, ponieważ zawiera liniowo wyrównane i kowalencyjnie połączone domeny katalityczne w obrębie dużych wielofunkcyjnych enzymów. Typ II jest zwykle bardziej dysocjowalnym kompleksem z jednofunkcyjnymi domenami enzymów. Innym sposobem, w jaki różnią się PKS-y, jest to, że mają jeden inny typ, typ III. PKS typu III są wielofunkcyjne przy wyborze jednostki startowej, montażu łańcucha i promowaniu składania.
Rodzina syntaz ketoacylowych 1
Prawie wszyscy członkowie KS1 są wytwarzani przez bakterie, z kilku uformowanych przez eukarionty, a tylko przez archeona. Istnieje 12 podrodzin. Dominującym enzymem w rodzinie KS1 jest 3-ketoacylo-ACP syntaza III (KAS III), znana również jako syntaza 3-oksoacylo-ACP III i β-ketoacylo-ACP syntaza III i jest zdefiniowana jako EC 2.3.1.180.
Syntaza β-ketoacylo-ACP III
Charakterystyczną reakcją syntazy β-ketoacylo-ACP III jest malonylo-ACP + acetylo-CoA => acetoacylo-ACP + CO 2 + CoA. Cysteina, histydyna i asparagina tworzą katalityczną triadę w KAS III, która wykorzystuje mechanizm kinetyczny ping-ponga.
U Escherichia coli , jeden organizm KAS III typowo występuje, KASIII jest słabo hamowany przez tiolaktomycynę. W tym samym organizmie KAS III będzie miał optymalne pH 7 i optymalną temperaturę 30-37 ° C. Inhibitory każdego organizmu, optymalne pH i optymalna temperatura będą się nieznacznie różnić. Jednak liczby te dość ogólnie wskazują na idealne środowisko enzymu.
Rodzina syntaz ketoacylowych 2
Wszystkie enzymy KS2 są produkowane przez eukariota, prawie wszystkie z roślin. Najbardziej powszechnymi enzymami z tej rodziny są syntazy 3-ketoacylo-CoA, elongazy kwasów tłuszczowych i enzymy kondensujące kwasy tłuszczowe o bardzo długich łańcuchach. Najbardziej powszechna ogólna charakterystyka tych enzymów to EC 2.3.1.-; jednak niektóre są zdefiniowane jako 2.3.1.119. Większość enzymów z rodziny KS2 katalizuje reakcje prowadzące do produkcji bardzo długołańcuchowych kwasów tłuszczowych. KS2 można podzielić na 10 podrodzin.
Syntaza 3-ketoacylo-CoA I.
Syntaza I 3-ketoacylo-CoA u Arabidopsis thaliana bierze udział w syntezie bardzo długołańcuchowych kwasów tłuszczowych, które odgrywają rolę w biosyntezie wosku. Enzym katalizuje następującą reakcję:
acylo-CoA o bardzo długim łańcuchu + malonylo-CoA ⇒ 3-oksoacylo-CoA o bardzo długim łańcuchu + CoA + CO 2
Wydaje się, że jest to elongaza zaangażowana w produkcję bardzo długołańcuchowych kwasów tłuszczowych, które mają 26 atomów węgla i więcej. Mefluidid i perfluidon są selektywnymi inhibitorami tego enzymu.
Rodzina syntaz ketoacylowych 3
Rodzina KS3 to największa rodzina w systemie KS, składająca się z 14 podrodzin. Enzymy KS3 są produkowane głównie przez bakterie, z niewielką liczbą eukariontów i archeonów. KS z tej rodziny zawierają domeny KS obecne zarówno w FAS typu I, jak i w modułach PKS typu I. Chociaż w tej rodzinie jest wiele nieco różnych enzymów, dwie najbardziej powszechne syntaza I i syntaza II 3-ketoacylo-ACP.
Syntaza 3-ketoacylo-ACP I.
Syntaza 3-ketoacylo-ACP I ( EC 2.3.1.41 ) bierze udział w procesie wydłużania łańcucha w FAS typu II. Konsekwencją braku tego enzymu będzie niedobór nienasyconych kwasów tłuszczowych. Wykorzystuje tłuszczowe tioestry acylowe ACP i CoA jako substraty i ma specyficzność zbliżoną do syntazy beta-ketoacylo-ACP II.
Zwykle enzym ten jest używany w reakcjach kondensacji, a także w dekarboksylacji i przeniesieniu grup acylowych.
Reakcja przebiega następująco:
- acyl- [białko nośnika acylowego] + malonylo- [białko nośnika acylowego] → 3-oksoacylo- [białko nośnika acylowego] + CO2 + [białko nośnikowe acylu]
Na przykład u Escherichia coli enzym ten jest używany do konstruowania tłuszczowych łańcuchów acylowych w trzystopniowej reakcji kondensacji Claisena. Reakcja rozpocznie się od trans tioestryfikacji podłoża podkładu acylowego. Podłoże donorowe jest następnie dekarboksylowane, tworząc związek pośredni karboanionu, który będzie atakował C1 substratu startera i tworzy wydłużony łańcuch acylowy.
Znanych jest wiele cząsteczek będących inhibitorami syntazy I. Na przykład, w niektórych przypadkach sam acylo-CoA hamuje enzym w wysokich stężeniach w Escherichia coli. Wiadomo, że cerulenina hamuje syntazę I u Carthamus tinctorius , Spinacia oleracea , Brassica napus , Allium ampeloprasu , Streptococcus pneumoniae , Escherichia coli , Mycobacterium tuberculosis i wielu innych. W Mycobacterium tuberculosis palmitoilo-CoA jest inhibitorem, podobnie jak tiolaktomycyna w wielu organizmach.
Optymalny zakres pH różni się znacznie w zależności od organizmu, ale ogólnie mieści się w granicach 5,5-8,5. Optymalna temperatura jest taka sama, z 20 ° C na jednym końcu spektrum i 37 ° C na drugim.
Syntaza 3-ketoacylo-ACP II
Syntaza 3-ketoacylo-ACP II bierze udział w FAS typu II, który występuje u roślin i bakterii. Chociaż syntaza I beta-ketoacylo-ACP jest bardzo podobna, istnieje niewielka różnica między nimi. Jedną z głównych różnic jest to, że syntaza II jest w stanie z łatwością używać palmitoilo-ACP jako substratu, podczas gdy syntaza I nie może. Pozwala to na kontrolę zależnej od temperatury regulacji składu kwasów tłuszczowych.
Reakcja przebiega następująco:
- ( Z ) -heksadec-11-enoilo- [białko nośnika acylowego] + malonylo- [białko nośnika acylowego] → ( Z ) -3-oksooktadec-13-enoilo- [białko nośnika acylowego] + CO 2 + [acyl -Białko nośnikowe
Na przykład w Streptococcus pneumoniae syntaza II jest stosowana jako enzym kondensujący wydłużanie. Zawiera katalityczną triadę Cys134, His337 i His303, a także Phe396 i cząsteczkę wody związaną z miejscem aktywnym. Nukleofilowa cysteina jest wymagana do tworzenia acyloenzymu i jest używana w ogólnej aktywności kondensacji. Jego 337 jest również używany do aktywności kondensacji, w szczególności stabilizacji ujemnego ładunku malonylo-tioestru-karbonylu w stanie przejściowym. His303 służy do przyspieszania katalizy poprzez deprotonowanie cząsteczki wody, aby umożliwić nukleofilowy atak na malonian, uwalniając w ten sposób wodorowęglan. Phe396 działa jako strażnik kontrolujący kolejność dodawania substratu.
Istnieje wiele cząsteczek, o których wiadomo, że hamują ten enzym. Na przykład cerulenina hamuje syntazę II u Spinacia oleracea , Allium ampelprasum , Escherichia coli i Streptoccoccus pneumonia . U Escherichia coli znanymi inhibitorami są również platensymycyna, tiolaktomycyna i jodoacetamid.
Optymalny zakres pH będzie różny w zależności od organizmu. U Escherichia coli zakres wynosi 5,5–6,1. U Streptoccoccus pneumoniae 6,8–7, Plasmodium falciparum 7,5 i Spinacia oleracea 8,1–8,5. Optymalna temperatura będzie się zmieniać, ale przeważnie pozostanie w zakresie 30–37 ° C.
Rodzina syntaz ketoacylowych 4
Większość enzymów KS4 występuje w organizmach eukariotycznych, podczas gdy reszta pochodzi z bakterii. Enzymy te są zwykle klasyfikowane jako syntazy chalkonu, syntazy stylbenu lub PKS typu III. Ogólnie w KS4 jest 10 różnych podrodzin. Zazwyczaj członkowie KS4 będą mieli katalityczną triadę Cys-His-Asn. Zarówno syntazy chalkonu, jak i syntazy stylbenu będą katalizować te same etapy transferu acylu, dekarboksylacji i kondensacji, jak w KS1. Jednak będą one również dalej cyklizować i aromatyzować reakcje, zanim powstanie końcowy produkt chalkonowy.
Syntaza chalkonowa
Za reakcję odpowiada syntaza chalkonowa ( EC 2.3.1.74 ), znana również jako syntaza naringenin- chalcone :
- 3 malonylo-CoA + 4-kumaroilo-CoA → 4 CoA + chalkon naryngeniny + 3 CO 2
Na przykład w Medicago sativa reakcja zachodzi w trakcie etapu ładowania, etapu dekarboksylacji i wreszcie etapu wydłużania.
Szereg inhibitorów obejmuje ceruleninę w zbożach Sinapis alba, Daucus carota i Phaseolus vulgaris , apigeninę w zbożach Secale i Avena sativa oraz eriodictyol w zbożach Decale, Daucus carota i Xanthisma gracile.
Optymalne pH, przy którym może funkcjonować ten enzym, różni się w zależności od organizmów, ale zazwyczaj mieści się w zakresie od 6 do 8. To samo dotyczy optymalnej temperatury 30-45 ° C.
Rodzina syntaz ketoacylowych 5
Wszyscy członkowie rodziny KS5 są obecni w komórkach eukariotycznych, głównie w zwierzętach. Większość z tych enzymów można sklasyfikować jako elongazy kwasów tłuszczowych. Wiadomo, że enzymy te są wykorzystywane do wydłużania bardzo długołańcuchowych kwasów tłuszczowych. KS5 ma 11 podrodzin. Niewiele jeszcze wiadomo o rodzinie KS5. Obecnie żaden z określonych enzymów nie ma numerów EC. Nie potwierdzono żadnych pozostałości triady katalitycznej. Stwierdzono konserwatywne reszty histydyny i asparaginy, z histydyną w regionie obejmującym błonę. Jednak nie są jeszcze znane konserwatywne reszty cysteiny.