ATPaza wodorowo-potasowa - Hydrogen potassium ATPase
| ATPaza, wymiana H+/K+, alfa polipeptyd | |||||||
|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||
| Symbol | ATP4A | ||||||
| Gen NCBI | 495 | ||||||
| HGNC | 819 | ||||||
| OMIM | 137216 | ||||||
| RefSeq | NM_000704 | ||||||
| UniProt | P20648 | ||||||
| Inne dane | |||||||
| Numer WE | 7.2.2.19 | ||||||
| Umiejscowienie | Chr. 19 q13.1 | ||||||
| |||||||
| ATP-aza, wymiana H+/K+, beta polipeptyd | |||||||
|---|---|---|---|---|---|---|---|
| Identyfikatory | |||||||
| Symbol | ATP4B | ||||||
| Gen NCBI | 496 | ||||||
| HGNC | 820 | ||||||
| OMIM | 137217 | ||||||
| RefSeq | NM_000705 | ||||||
| UniProt | P51164 | ||||||
| Inne dane | |||||||
| Numer WE | 7.2.2.19 | ||||||
| Umiejscowienie | Chr. 13 q34 | ||||||
| |||||||
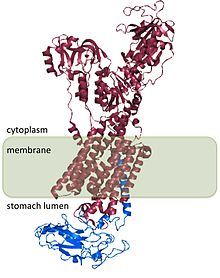
ATP-aza potasowo-wodorowa żołądka , znana również jako ATP - aza H + /K + , jest enzymem, który zakwasza żołądek. Jest to element o ATPazy typu P , znane także jako E 1 -P 2 ATPazy powodu dwóch stanach.
Funkcja biologiczna i lokalizacja
Żołądka potasu wodoru ATPazy lub H + / K + ATPazy jest pompy protonowej w żołądku . Wymienia potasu z przewodu pokarmowego światła z cytoplazmy hydroniowego i enzym odpowiedzialny przede wszystkim za zakwaszania zawartości żołądka i aktywacji enzymu pokarmowego pepsyna (patrz na kwas żołądkowy ).
H + /K + ATPaza znajduje się w komórkach okładzinowych , które są wysoce wyspecjalizowanymi komórkami nabłonkowymi zlokalizowanymi w wewnętrznej wyściółce żołądka zwanej błoną śluzową żołądka . Komórki okładzinowe posiadają rozległy system błon wydzielniczych, a H + /K + ATPaza jest głównym składnikiem białkowym tych błon. Niewielka ilość H + /K + ATPazy znajduje się również w rdzeniu nerki .
Geny i struktura białek
H + /K + ATPaza jest białkiem heterodimerycznym , produktem 2 genów. Gen ATP4A koduje podjednostkę H + /K + ATPazy α i jest ~1000-aminokwasowym białkiem, które zawiera miejsca katalityczne enzymu i tworzy otwór w błonie komórkowej, który umożliwia transport jonów. Jony hydroniowe wiążą się z dwoma miejscami aktywnymi obecnymi w podjednostce α. Α podjednostka posiada również miejsca wiązania (Asp 385 ). Gen ATP4B koduje podjednostkę β ATPazy H + /K + , która jest ~300-aminokwasowym białkiem z 36-aminokwasową N-końcową domeną cytoplazmatyczną, pojedynczą domeną transbłonową i wysoce glikozylowaną domeną zewnątrzkomórkową.
Podjednostka H + /K + ATPazy β stabilizuje podjednostkę H + /K + ATPazy α i jest wymagana do działania enzymu. Podjednostka β zapobiega odwrotnemu działaniu pompy, a także wydaje się, że zawiera sygnały, które kierują heterodimer do miejsc docelowych w błonie komórkowej, chociaż niektóre z tych sygnałów są podporządkowane sygnałom znalezionym w podjednostce H + /K + ATPazy α.
Struktura H + /K + ATPazy została określona dla ludzi, psów, świń, szczurów i królików i jest w 98% homologiczna u wszystkich gatunków.
Mechanizm i aktywność enzymatyczna
H + / K + ATPazy oznacza p 2 typu a ATPazy członkiem eukariotycznej klasy typu P ATPazy . Jak Ca 2+ i Na + / K + ATPazy, H + / K + funkcji ATPazy jako a, β protomeru. W przeciwieństwie do innych ATPaz eukariotycznych, ATP - aza H + /K + jest elektroneutralna, transportując jeden proton do światła żołądka na potas pobrany ze światła żołądka. Jako pompa jonowa H + /K + ATPaza jest w stanie transportować jony wbrew gradientowi stężeń przy użyciu energii pochodzącej z hydrolizy ATP. Jak wszystkie ATPazy typu P, grupa fosforanowa jest przenoszona z adenozynotrifosforanu (ATP) do ATPazy H + /K + podczas cyklu transportu. Ten transfer fosforanów napędza zmianę konformacyjną enzymu, która pomaga w kierowaniu transportem jonów.
ATPaza wodorowo-potasowa jest aktywowana pośrednio przez gastrynę, która powoduje, że komórki ECL uwalniają histaminę . Histamina wiąże się z receptorami H2 w komórce okładzinowej, aktywując szlak zależny od cAMP, który powoduje, że enzym przemieszcza się z błon kanalików cytoplazmatycznych do głęboko pofałdowanych kanalików stymulowanej komórki okładzinowej. Po zlokalizowaniu enzym zmienia się między dwiema konformacjami, E1 i E2, aby transportować jony przez błonę.
Konformacja E1 wiąże fosforan z ATP i jon hydroniowy po stronie cytoplazmatycznej. Enzym przechodzi następnie w konformację E2, umożliwiając uwolnienie hydronu w świetle. Konformacja E2 wiąże potas i powraca do konformacji E1, aby uwolnić fosforan i K + do cytoplazmy, gdzie inny ATP może być hydrolizowany, aby powtórzyć cykl. Podjednostka β zapobiega powrotowi konformacji E2-P do konformacji E1-P, dzięki czemu pompowanie protonów jest jednokierunkowe. Liczba jonów transportowanych przez ATP waha się od 2H + /2K + do 1H + /1K + w zależności od pH żołądka.
Znaczenie i zahamowanie choroby
Hamowanie pompy wodorowo-potasowej w celu zmniejszenia kwasowości żołądka jest najczęstszą metodą leczenia chorób, w tym choroby refluksowej przełyku (GERD/GORD) i choroby wrzodowej żołądka (PUD). Zmniejszenie kwasowości łagodzi objawy choroby, ale nie leczy rzeczywistej przyczyny GERD (nieprawidłowego rozluźnienia zwieracza przełyku) lub PUD ( Helicobacter pylori i NLPZ ).
Do hamowania H + /K + -ATPaz zastosowano trzy klasy leków . H 2 antagoniści receptora , jak cymetydyna (Tagamet) hamowania szlaku sygnalizacyjnego, który prowadzi do aktywacji ATPazy. Ten rodzaj inhibitora jest skuteczny w leczeniu wrzodów, ale nie zapobiega ich powstawaniu, a pacjenci rozwijają tolerancję na nie po około tygodniu, prowadząc do 50% zmniejszenia skuteczności. Inhibitory pompy protonowej (PPI) zostały później opracowane, począwszy od Timoprazolu w 1975 roku. PPI to aktywowane kwasem proleki, które hamują ATP-azę wodorowo-potasową poprzez wiązanie kowalencyjne z aktywnymi pompami. Obecne PPI, takie jak Omeprazol, mają krótki okres półtrwania wynoszący około 90 minut. Antagoniści pompy kwasowej (APA) lub blokery kwasu konkurencyjnego wobec potasu (PCAB) to trzeci rodzaj inhibitora, który blokuje wydzielanie kwasu poprzez wiązanie się z miejscem aktywnym K + . APA zapewniają szybsze hamowanie niż PPI, ponieważ nie wymagają aktywacji kwasem. Revaprazan był pierwszym APA stosowanym klinicznie we wschodniej Azji, a inne APA są opracowywane, ponieważ wydają się zapewniać lepszą kontrolę kwasu w badaniach klinicznych.
Dezaktywacja pompy protonowej może również prowadzić do problemów zdrowotnych. Badanie na myszach przeprowadzone przez Kriega i in. odkryli, że mutacja podjednostki α pompy prowadziła do achlorhydrii , powodując problemy z wchłanianiem żelaza, prowadząc do niedoboru żelaza i anemii . Stosowanie PPI nie jest skorelowane z podwyższonym ryzykiem anemii, dlatego uważa się , że H + /K + -ATPaza wspomaga wchłanianie żelaza, ale niekoniecznie jest wymagana.
Obecne powiązanie demencji i PPI zostało udokumentowane w Niemczech oraz w artykułach naukowych opisujących, w jaki sposób pochodne benzimidazolu, astemizol (AST) i lansoprazol (LNS) oddziałują z anomalnymi agregatami białka tau (plątki neurofibrylarne). Aktualne teorie obejmują nieselektywną blokadę pomp sodowo-potasowych w mózgu, powodującą zaburzenia równowagi osmotycznej lub obrzęk komórek. [opinia autora] Interakcje PPI z innymi lekami wpływającymi na pompę sodowo-potasową, np. digoksyną, warfaryną itp., zostały dobrze udokumentowane. Pamięć została powiązana z astrocytami, a podjednostka alfa3 receptora adenozynowego znajdująca się w pompach wodorowych/sodowo-potasowych może być centralnym punktem w demencji. Przewlekłe stosowanie PPI może powodować regulację w dół podjednostki alfa3, zwiększając uszkodzenie astrocytów. Osteopetroza za pośrednictwem genu TCIRG1 ma silny związek z otępieniem przedstarczym.
Zobacz też
Bibliografia
Zewnętrzne linki
- Yao X, Forte JG (2003). „Biologia komórkowa wydzielania kwasu przez komórkę okładzinową” . Annu. Ks . Physiol . 65 : 103-31. doi : 10.1146/annurev.physiol.65.072302.114200 . PMID 1250969 .
- Kühlbrandt W (kwiecień 2004). „Biologia, struktura i mechanizm ATPaz typu P”. Nat. Ks. Mol. Biol komórki . 5 (4): 282–95. doi : 10.1038/nrm1354 . PMID 15071553 . S2CID 24927167 .
- Dunbar LA, Caplan MJ (sierpień 2001). "Pompy jonowe w ogniwach spolaryzowanych: sortowanie i regulacja ATPaz Na + , K + - i H + , K + " . J. Biol. Chem . 276 (32): 29617-20. doi : 10.1074/jbc.R100023200 . PMID 11404365 .
- Sachs G, Shin JM, Briving C, Wallmark B, Hersey S (1995). „Farmakologia pompy kwasu żołądkowego: H + ,K + ATPaza” . Annu. ks. Pharmacol. Toksykol . 35 : 277–305. doi : 10.1146/annurev.pa.35.040195.001425 . PMID 7598495 .
- Potas + wodór + ATP-aza w amerykańskiej National Library of Medicine Medical Subject Headings (MeSH)