Humanizowane przeciwciało - Humanized antibody
Humanizowane przeciwciała to przeciwciała z gatunków innych niż człowiek, których sekwencje białkowe zostały zmodyfikowane w celu zwiększenia ich podobieństwa do wariantów przeciwciał wytwarzanych naturalnie u ludzi. Proces „humanizacji” jest zwykle stosowany do przeciwciał monoklonalnych opracowanych do podawania ludziom (na przykład przeciwciał opracowanych jako leki przeciwnowotworowe). Humanizacja może być konieczna, gdy proces opracowywania konkretnego przeciwciała obejmuje generowanie w układzie odpornościowym innym niż człowiek (takim jak u myszy). Sekwencje białkowe przeciwciał wytworzonych w ten sposób są częściowo różne od przeciwciał homologicznych występujących naturalnie u ludzi, a zatem są potencjalnie immunogenne przy podawaniu ludziom (patrz także: Ludzkie przeciwciało anty-mysie ). Te międzynarodowe niezastrzeżonych nazw humanizowanych przeciwciał zakończyć w -zumab , jak w omalizumabu (patrz scalonej przeciwciał monoklonalnych ).
Humanizowane przeciwciała różnią się od przeciwciał chimerycznych . Te ostatnie również mają swoje sekwencje białkowe bardziej podobne do ludzkich przeciwciał, ale przenoszą większy odcinek białka innego niż ludzkie.
Istnieją inne sposoby wytwarzania przeciwciał monoklonalnych. Ta lista obejmuje wiele leków monoklonalnych opracowanych do stosowania u ludzi.
Wykorzystanie rekombinowanego DNA w procesie humanizacji
Proces humanizacji wykorzystuje fakt, że wytwarzanie przeciwciał monoklonalnych można osiągnąć przy użyciu rekombinowanego DNA w celu stworzenia konstruktów zdolnych do ekspresji w hodowli komórek ssaków . Oznacza to, że segmenty genów zdolne do wytwarzania przeciwciał są izolowane i klonowane do komórek, które można hodować w bioreaktorze tak, że białka przeciwciał wytworzone z DNA sklonowanych genów mogą być zbierane masowo . Etap obejmujący rekombinowany DNA zapewnia punkt interwencji, który można łatwo wykorzystać do zmiany sekwencji białka eksprymowanego przeciwciała. Zmiany w strukturze przeciwciała, które są osiągane w procesie humanizacji, są zatem dokonywane za pomocą technik na poziomie DNA. Nie wszystkie sposoby uzyskiwania przeciwciał przeznaczonych do leczenia ludzi wymagają etapu humanizacji (np. prezentacji fagowej ), ale zasadniczo wszystkie są zależne od technik, które podobnie umożliwiają „wstawienie” lub „wymianę” części cząsteczki przeciwciała.
Odróżnienie od „przeciwciała chimerycznego”
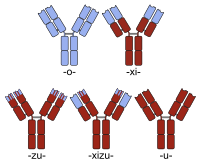
Humanizacja jest zwykle postrzegana jako odmienna od tworzenia chimery mysio-ludzkiego przeciwciała . Tak więc, chociaż tworzenie chimery przeciwciała jest zwykle podejmowane w celu uzyskania przeciwciała bardziej podobnego do człowieka (poprzez zastąpienie regionu stałego mysiego przeciwciała regionem ludzkim), proste chimery tego typu nie są zwykle określane jako humanizowane. Przeciwnie, sekwencja białka humanizowanego przeciwciała jest zasadniczo identyczna z sekwencją ludzkiego wariantu, pomimo pochodzenia innego niż ludzkie niektórych segmentów regionu determinującego komplementarność (CDR) odpowiedzialnych za zdolność przeciwciała do wiązania się z jego docelowym antygenem .
Nazwy przeciwciał chimerycznych zawierają -xi- . Przykłady przeciwciał chimerycznych zatwierdzonych do leczenia ludzi obejmują abciximab (ReoPro), bazyliksymab (Simulect), cetuksymab (Erbitux), infliksymab (Remicade) i rituximab (MabThera). Istnieje również kilka przykładów chimerów będących obecnie w badaniach klinicznych (np. bawituksymab , dodatkowe przykłady można znaleźć na liście sortowalnej ).
Humanizowanie za pomocą chimerycznego produktu pośredniego
Proces humanizacji może również obejmować tworzenie chimery mysio-ludzkiej jako wstępny etap. W tym przypadku mysi region zmienny jest połączony z ludzkim regionem stałym. Chimerę można następnie dalej humanizować przez selektywną zmianę sekwencji aminokwasów w regionie zmiennym cząsteczki.
Proces zmiany musi być „selektywny”, aby zachować specyficzność, dla której przeciwciało zostało pierwotnie opracowane. To znaczy, ponieważ części CDR regionu zmiennego są niezbędne dla zdolności przeciwciała do wiązania się z zamierzonym celem, aminokwasy w tych częściach nie mogą być zmieniane bez ryzyka podważenia celu opracowania. Oprócz segmentów CDR, części regionów zmiennych, które różnią się od tych u ludzi, można skorygować poprzez wymianę odpowiednich pojedynczych aminokwasów. Odbywa się to na poziomie DNA poprzez mutagenezę .
Nazewnictwo chimer humanizowanych obejmuje rdzeń dla obu oznaczeń ( -xi- + -zu- ). Otelixizumab jest przykładem chimery humanizowanej obecnie w badaniach klinicznych w leczeniu reumatoidalnego zapalenia stawów i cukrzycy .
Humanizacja przez wprowadzenie odpowiednich CDR do „rusztowania” ludzkiego przeciwciała
Możliwe jest wytworzenie humanizowanego przeciwciała bez tworzenia chimerycznego produktu pośredniego. „Bezpośrednie” tworzenie humanizowanego przeciwciała można osiągnąć przez wprowadzenie odpowiednich segmentów kodujących CDR (tak zwanych „donorów”, odpowiedzialnych za pożądane właściwości wiązania) do „rusztowania” ludzkiego przeciwciała (tak zwanego „akceptorem”). Jak omówiono powyżej, osiąga się to metodami rekombinacji DNA przy użyciu odpowiedniego wektora i ekspresji w komórkach ssaków. Oznacza to, że po opracowaniu przeciwciała, które ma pożądane właściwości u myszy (lub innej osoby niebędącej człowiekiem), DNA kodujący to przeciwciało można wyizolować, sklonować do wektora i zsekwencjonować . Następnie można określić sekwencję DNA odpowiadającą CDR przeciwciała. Gdy znana jest dokładna sekwencja pożądanych CDR, można opracować strategię odpowiedniego wstawienia tych sekwencji do konstruktu zawierającego DNA dla wariantu ludzkiego przeciwciała. Strategia może również wykorzystywać syntezę liniowych fragmentów DNA na podstawie odczytu sekwencji CDR.
Alemtuzumab jest wczesnym przykładem przeciwciała, którego humanizacja nie obejmowała chimerycznego produktu pośredniego. W tym przypadku, monoklonalny nazwany „Campath-1” został opracowany do wiązania CD52 przy użyciu systemu myszy. Hiperzmienne pętle Campath-1 (zawierające CDR, a tym samym nadające jego zdolność do wiązania CD52) zostały następnie wyekstrahowane i wstawione do zrębu ludzkiego przeciwciała. Alemtuzumab jest zarejestrowany do leczenia przewlekłej białaczki limfocytowej z komórek B i jest obecnie w badaniach klinicznych dotyczących wielu innych schorzeń, w tym stwardnienia rozsianego .
Pochodzenie ze źródeł innych niż myszy
Istnieją technologie, które całkowicie unikają wykorzystywania myszy lub innych ssaków innych niż człowiek w procesie odkrywania przeciwciał do terapii ludzi. Przykłady takich systemów obejmują różne metody „ekspozycji” (głównie prezentację fagową ), jak również metody wykorzystujące podwyższone poziomy limfocytów B, które występują podczas ludzkiej odpowiedzi immunologicznej.
Metody wyświetlania
Wykorzystują one selektywne zasady wytwarzania specyficznych przeciwciał, ale wykorzystują mikroorganizmy (jak w prezentacji fagowej ) lub nawet ekstrakty bezkomórkowe (jak w prezentacji rybosomalnej ). Systemy te opierają się na tworzeniu „bibliotek” genów przeciwciał, które mogą być w całości wyprowadzone z ludzkiego RNA wyizolowanego z krwi obwodowej . Bezpośrednimi produktami tych systemów są fragmenty przeciwciał, zwykle Fab lub scFv .
Oznacza to, że chociaż fragmenty przeciwciał utworzone za pomocą metod prezentacji mają w pełni ludzką sekwencję, nie są to pełne przeciwciała. Dlatego też procesy zasadniczo identyczne z humanizacją są stosowane do włączania i wyrażania uzyskanych powinowactw w obrębie pełnego przeciwciała.
Adalimumab (Humira) jest przykładem przeciwciała zatwierdzonego do terapii u ludzi, które zostało stworzone poprzez prezentację fagową.
Przeciwciała od ludzkich pacjentów lub biorców szczepionki
Możliwe jest wykorzystanie ludzkiej reakcji immunologicznej w odkryciu przeciwciał monoklonalnych. Mówiąc najprościej, ludzka odpowiedź immunologiczna działa w taki sam sposób, jak u myszy lub innego ssaka innego niż człowiek. Dlatego osoby doświadczające prowokacji układu odpornościowego, takiej jak choroba zakaźna, nowotwór lub szczepienie, są potencjalnym źródłem przeciwciał monoklonalnych skierowanych przeciwko tej prowokacji. Takie podejście wydaje się szczególnie trafne dla rozwoju terapii przeciwwirusowych wykorzystujących zasady odporności biernej . Warianty tego podejścia zostały w zasadzie zademonstrowane, a niektóre z nich znajdują zastosowanie w rozwoju komercyjnym.
