Plamica Henocha-Schönleina - Henoch–Schönlein purpura
| Plamica Henocha-Schönleina | |
|---|---|
| Inne nazwy | zapalenie naczyń IgA, plamica rzekomoanafilaktyczna, plamica reumatyczna, plamica Schönleina-Henocha |
 | |
| Typowa plamica na podudziach i pośladkach | |
| Wymowa | |
| Specjalność | Reumatologia , Immunologia |
Plamica Henocha-Schönleina ( HSP ), znana również jako zapalenie naczyń IgA , to choroba skóry , błon śluzowych , a czasami innych narządów , najczęściej występująca u dzieci . W skórze choroba powoduje wyczuwalną plamicę (niewielkie, wypukłe obszary krwawienia pod skórą), często z bólem stawów i bólem brzucha . W przypadku zajęcia nerek może wystąpić utrata niewielkich ilości krwi i białka w moczu ( krwiomocz i białkomocz), ale zwykle pozostaje to niezauważone; w niewielkim odsetku przypadków zajęcie nerek przechodzi w przewlekłą chorobę nerek . HSP jest często poprzedzone infekcją , taką jak infekcja gardła .
HSP układowe zapalenie naczyń ( zapalenie z naczyń krwionośnych ) i charakteryzuje się odkładaniem kompleksów immunologicznych zawierających przeciwciało immunoglobuliny A (IgA); dokładna przyczyna tego zjawiska nie jest znana. U dzieci zwykle ustępuje w ciągu kilku tygodni i nie wymaga leczenia poza kontrolą objawów, ale może nawrócić w jednej trzeciej przypadków i spowodować nieodwracalne uszkodzenie nerek w około jednym na sto przypadków. U dorosłych rokowanie jest inne niż u dzieci. Średni czas trwania zmian skórnych wynosi 27,9 miesiąca. U wielu osób ma tendencję do nawracania – ustępowania przez długi czas, a nie samoograniczania się i zwykle występuje więcej komplikacji.
Symptomy i objawy

Plamica , zapalenie stawów i ból brzucha są znane jako „klasyczna triada” plamicy Henocha-Schönleina. Plamica występuje we wszystkich przypadkach, bóle stawów i artretyzm w 80%, a bóle brzucha w 62%. Niektóre obejmują krwotok z przewodu pokarmowego jako czwarte kryterium; zdarza się to w 33% przypadków, czasami, ale nie zawsze, z powodu wgłobienia . Plamica zwykle pojawia się na nogach i pośladkach, ale może być również widoczna na ramionach, twarzy i tułowiu. Ból brzucha ma charakter kolkowy i mogą mu towarzyszyć nudności, wymioty, zaparcia lub biegunka. W stolcu może znajdować się krew lub śluz. Zajęte stawy to zwykle kostki , kolana i łokcie , ale możliwe jest zapalenie stawów rąk i stóp; zapalenie stawów nie jest erozyjne, a zatem nie powoduje trwałej deformacji. Czterdzieści procent ma dowody na zajęcie nerek , głównie w postaci krwiomoczu (krew w moczu), ale tylko jedna czwarta będzie miała to w wystarczających ilościach, aby było to zauważalne bez badań laboratoryjnych. Mogą wystąpić problemy w innych narządach, takich jak ośrodkowy układ nerwowy (mózg i rdzeń kręgowy) i płuca , ale są one znacznie rzadsze niż w przypadku skóry, jelit i nerek.
Spośród 40% pacjentów, u których rozwija się zajęcie nerek, prawie wszyscy mają dowody (widoczne lub w badaniu moczu ) krwi w moczu. Ponad połowa ma również białkomocz (białko w moczu), który w jednej ósmej jest na tyle ciężki, że powoduje zespół nerczycowy (uogólniony obrzęk spowodowany niską zawartością białka we krwi). Chociaż nieprawidłowości w analizie moczu mogą utrzymywać się przez długi czas, tylko 1% wszystkich pacjentów z HSP rozwija przewlekłą chorobę nerek . Może wystąpić nadciśnienie (wysokie ciśnienie krwi). Utrata białka i wysokie ciśnienie krwi, a także cechy biopsji nerki, jeśli są wykonywane, mogą przewidzieć progresję do zaawansowanej choroby nerek. Dorośli są bardziej narażeni niż dzieci na zaawansowaną chorobę nerek.
Patofizjologia
Plamica Henocha-Schönleina to zapalenie małych naczyń, w którym kompleksy immunoglobuliny A (IgA) i składnika dopełniacza 3 (C3) odkładają się na tętniczkach, naczyniach włosowatych i żyłkach (stąd jest to reakcja nadwrażliwości typu III). Podobnie jak w przypadku nefropatii IgA , w HSP stężenie IgA w surowicy jest wysokie, a wyniki biopsji nerki są identyczne; jednak nefropatia IgA ma skłonność do młodych dorosłych, podczas gdy HSP dominuje wśród dzieci. Co więcej, nefropatia IgA zazwyczaj atakuje tylko nerki, podczas gdy HSP jest chorobą ogólnoustrojową. HSP obejmuje skórę i tkankę łączną, mosznę, stawy, przewód pokarmowy i nerki. Podstawa genetyczna pozostaje niejasna, z wyjątkiem zaangażowania regionu ludzkiego antygenu leukocytów w genomie. Przypuszcza się, że obejmuje autoimmunizację wywołaną przez infekcje, w szczególności Staphylococcus aureus, Mycoplasma i adenowirus.
Diagnoza
Diagnoza opiera się na kombinacji objawów, ponieważ bardzo niewiele innych chorób powoduje razem te same objawy. Badania krwi mogą wykazywać podwyższony poziom kreatyniny i mocznika (w przypadku zajęcia nerek), podwyższony poziom IgA (o około 50%) oraz podwyższony wynik białka C-reaktywnego (CRP) lub wskaźnika sedymentacji erytrocytów (OB); żadne nie są specyficzne dla plamicy Henocha-Schönleina. Liczba płytek krwi może być podwyższona i odróżnia ją od chorób, w których przyczyną plamicy jest niska liczba płytek krwi, takich jak idiopatyczna plamica małopłytkowa i zakrzepowa plamica małopłytkowa .
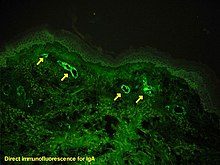
W przypadku wątpliwości co do przyczyny zmian skórnych można wykonać biopsję skóry w celu odróżnienia plamicy od innych chorób, które ją wywołują, takich jak zapalenie naczyń z powodu krioglobulinemii ; pod mikroskopem widać objawy nadwrażliwego zapalenia naczyń , a immunofluorescencja wykazuje obecność IgA i C3 (białka układu dopełniacza ) w ścianie naczynia krwionośnego. Jednak ogólne poziomy dopełniacza w surowicy są w normie.
Na podstawie objawów można odróżnić HSP od nadwrażliwego zapalenia naczyń (HV). W serii porównującej 85 pacjentów z HSP z 93 pacjentami z HV stwierdzono, że pięć objawów wskazuje na HSP: wyczuwalna plamica, dusznica bolesna , krwotok z przewodu pokarmowego (niezwiązany z wgłobieniem), krwiomocz i wiek poniżej 20 lat. więcej z tych wskaźników ma 87% czułość przewidywania HSP.
Biopsję nerki można wykonać zarówno w celu ustalenia rozpoznania, jak i oceny nasilenia już podejrzewanej choroby nerek. Główne wyniki biopsji nerki to zwiększone odkładanie się komórek i Ig w mezangium (część kłębuszka , gdzie filtrowana jest krew), białe krwinki i rozwój półksiężyców . Zmiany są nie do odróżnienia od obserwowanych w nefropatii IgA .
HSP może rozwinąć się po infekcjach paciorkowcami ( β-hemolizujące, grupa Lancefielda A ), wirusowym zapaleniem wątroby typu B , wirusem opryszczki zwykłej , parwowirusem B19 , wirusem Coxsackie , adenowirusem , Helicobacter pylori , odrą , świnką , różyczką , mykoplazmą i wieloma innymi. Leki powiązane z HSP, zwykle jako reakcja idiosynkratyczna, obejmują antybiotyki wankomycynę i cefuroksym , inhibitory ACE enalapryl i kaptopryl , środek przeciwzapalny diklofenak , a także ranitydynę i streptokinazę . Istnieją doniesienia, że kilka chorób jest związanych z HSP, często bez związku przyczynowego. Tylko w około 35% przypadków można przypisać HSP do którejkolwiek z tych przyczyn.
Dokładna przyczyna HSP nie jest znana, ale większość jego cech wynika z odkładania się nieprawidłowych przeciwciał w ścianie naczyń krwionośnych, co prowadzi do zapalenia naczyń . Te przeciwciała podklasy IgA 1 w polimerów ; nie ma pewności, czy główną przyczyną jest nadprodukcja (w przewodzie pokarmowym lub szpiku kostnym ), czy też zmniejszone usuwanie nieprawidłowych IgA z krążenia. Podejrzewa się , że nieprawidłowości w cząsteczce IgA 1 mogą wyjaśniać jej nieprawidłowe zachowanie zarówno w HSP , jak iw pokrewnej nefropatii IgA . Jedną z cech charakterystycznych IgA 1 (i IgD ) jest obecność 18- aminokwasowego „regionu zawiasowego” między regionami wiązania dopełniacza 1 i 2. Spośród aminokwasów połowa to prolina , podczas gdy pozostałe to głównie seryna i treonina . Większość seryny i treoniny ma skomplikowane łańcuchy cukrowe, połączone atomami tlenu ( O-glikozylacja ). Uważa się, że proces ten stabilizuje cząsteczkę IgA i czyni ją mniej podatną na proteolizę . Pierwszym cukrem jest zawsze N-acetylogalaktozamina (GalNAc), a następnie inne galaktozy i kwas sialowy . W HSP i IgAN te łańcuchy cukrowe wydają się mieć niedobór. Dokładna przyczyna tych nieprawidłowości nie jest znana.
Klasyfikacja
Istnieje wiele standardów definiowania plamicy Henocha-Schönleina, w tym klasyfikacja American College of Rheumatology (ACR) z 1990 r. oraz Konferencja Consensusu Chapel Hill (CHCC) z 1994 r. Niektórzy twierdzą, że kryteria ACR są bardziej wrażliwe niż kryteria CHCC.
Nowsze klasyfikacje, klasyfikacja Europejskiej Ligi Przeciw Reumatyzmowi (EULAR) i Pediatric Rheumatology Society (PReS) z 2006 r., uwzględniają plamicę wyczuwalną palpacyjnie jako obowiązkowe kryterium, wraz z co najmniej jednym z następujących objawów: rozlany ból brzucha, dominujące odkładanie IgA (potwierdzone na biopsja skóry), ostre zapalenie stawów w dowolnym stawie i zajęcie nerek (o czym świadczy obecność krwi i (lub) białka w moczu).
Diagnostyka różnicowa
Plamica Henocha-Schönleina może mieć nietypowe objawy, które można pomylić z pokrzywką grudkową , toczniem rumieniowatym układowym , meningokokemią , opryszczkowatym zapaleniem skóry i ostrym obrzękiem krwotocznym niemowlęcym .
Leczenie
Od 2017 r. optymalny sposób leczenia plamicy Henocha-Schönleina pozostaje kontrowersyjny. W przypadku bólów brzucha i stawów mogą być potrzebne środki przeciwbólowe . Opieka nad ranami jest uzasadniona w przypadku śmierci skóry i owrzodzeń. Nie ma pewności, czy HSP wymaga leczenia poza kontrolowaniem objawów. Większość osób nie otrzymuje terapii z powodu wysokiego współczynnika samoistnego powrotu do zdrowia. Eksperci nie są zgodni, czy rutynowo stosować kortykosteroidy w leczeniu HSP. Jeśli jednak zostaną podane na początku epizodu choroby, czas trwania objawów może ulec skróceniu, a ból brzucha może ulec znacznej poprawie. Co więcej, ryzyko poważnych problemów z nerkami może być zmniejszone. Przegląd systematyczny nie znalazł żadnych dowodów na to, że leczenie sterydami ( prednizonem ) skutecznie zmniejsza prawdopodobieństwo rozwoju długotrwałej choroby nerek.
Dowody pogarszającego się uszkodzenia nerek zwykle skłaniają do biopsji nerki. Leczenie może być wskazane na podstawie wyglądu próbki biopsyjnej; Można stosować różne terapie, od doustnych steroidów do kombinacji dożylnego metyloprednizolonu (steroidu), cyklofosfamidu i dipirydamolu, a następnie prednizonu. Inne schematy obejmują steroidy/ azatioprynę i steroidy/cyklofosfamid (z heparyną i warfaryną lub bez ). Sporadycznie stosuje się immunoglobulinę dożylną (IVIG).
Nie ma dobrych dowodów na to, że leczenie dzieci z HSP lekiem przeciwpłytkowym zapobiega uporczywej chorobie nerek. Nie ma również dowodów na to, że leczenie dzieci lub dorosłych cyklofosfamidem zapobiega ciężkiej chorobie nerek. Leczenie heparyną nie jest uzasadnione.
Rokowanie
Ogólne rokowanie jest dobre u większości pacjentów, a jedno badanie wykazało powrót do zdrowia odpowiednio u 94% i 89% dzieci i dorosłych (niektórzy wymagali leczenia). U dzieci poniżej dziesiątego roku życia stan powraca w około jednej trzeciej wszystkich przypadków, zwykle w ciągu czterech miesięcy od pierwszego ataku. Nawrót występuje częściej u starszych dzieci i dorosłych.
Zaangażowanie nerek
U dorosłych zajęcie nerek postępuje do schyłkowej choroby nerek (ESKD) częściej niż u dzieci. W brytyjskiej serii 37 pacjentów u 10 (27%) rozwinęła się zaawansowana choroba nerek. Białkomocz, nadciśnienie w chwili wystąpienia i cechy patologiczne (zmiany półksiężycowe, zwłóknienie śródmiąższowe i atrofia kanalików) przewidywały progresję. Około 20% dzieci z cechami nerczycowymi lub nerczycowymi doświadcza długotrwałej trwałej niewydolności nerek.
Wyniki biopsji nerki korelują z nasileniem objawów: osoby z bezobjawowym krwiomoczem mogą mieć jedynie ogniskową proliferację mezangialną, podczas gdy osoby z białkomoczem mogą mieć wyraźną proliferację komórek lub nawet tworzenie się półksiężyców. Liczba kłębuszków w kształcie półksiężyca jest ważnym czynnikiem prognostycznym w określaniu, czy u pacjenta rozwinie się przewlekła choroba nerek.
W przypadku ESKD niektórzy ostatecznie wymagają hemodializy lub równoważnej terapii nerkozastępczej (RRT). W przypadku znalezienia przeszczepu nerki u pacjenta stosującego RRT, choroba powróci w przeszczepie (przeszczepiona nerka) w około 35% przypadków, a w 11% przeszczep zakończy się niepowodzeniem (wymaga wznowienia RRT i kolejnego przeszczepu). ).
Epidemiologia
HSP występuje częściej u dzieci niż u dorosłych i zwykle następuje po infekcji górnych dróg oddechowych . Połowa dotkniętych chorobą pacjentów ma mniej niż sześć lat, a 90% ma mniej niż dziesięć lat. Występuje około dwa razy częściej u chłopców niż u dziewcząt. Występowania z HSP u dzieci jest około 20 100 tysięcy dzieci rocznie, co czyni go najczęściej zapalenie naczyń u dzieci.
Przypadki HSP mogą wystąpić w dowolnym momencie w ciągu roku, ale niektóre badania wykazały, że mniej przypadków występuje w miesiącach letnich.
Historia
Choroba nosi imię Eduarda Heinricha Henocha (1820-1910), niemieckiego pediatry (bratanka Moritza Heinricha Romberga ) i jego nauczyciela Johanna Lukasa Schönleina (1793-1864), który opisał ją w latach 60. XIX wieku. Schönlein powiązał plamicę i zapalenie stawów, a Henocha plamicę i zajęcie przewodu pokarmowego. Angielski lekarz William Heberden (1710–1801) i dermatolog Robert Willan (1757–1812) opisali tę chorobę odpowiednio w 1802 i 1808 r., ale nazwa choroba Heberdena- Willana wyszła z użycia. William Osler był pierwszym, który rozpoznał leżący u podstaw mechanizm alergiczny HSP.
Zobacz też
Bibliografia
Zewnętrzne linki
| Klasyfikacja | |
|---|---|
| Zasoby zewnętrzne |