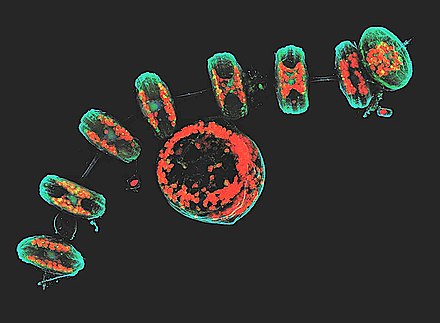
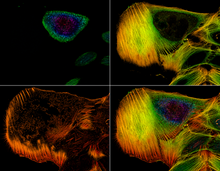
Mikroskopia konfokalna - Confocal microscopy
| Mikroskopia konfokalna | |
|---|---|
| Siatka | D018613 |
| Kod OPS-301 | 3-301 |
Mikroskopii konfokalnej , najczęściej konfokalnego laserowego skaningowego mikroskopu ( CLSM ) lub laserowego konfokalnego mikroskopu skaningowego ( LCSM ), to optyczny technika obrazowania dla zwiększenia rozdzielczość optyczną i kontrast o mikroskopu za pomocą za pomocą otworkowej przestrzennego blokować out-of-focus światła w tworzeniu wizerunku. Przechwytywanie wielu dwuwymiarowych obrazów na różnych głębokościach w próbce umożliwia rekonstrukcję trójwymiarowych struktur (proces znany jako przekrój optyczny ) w obiekcie. Technika ta jest szeroko stosowana w środowisku naukowym i przemysłowym, a jej typowe zastosowania to nauki przyrodnicze , kontrola półprzewodników i materiałoznawstwo .
Światło przechodzi przez próbkę pod konwencjonalnym mikroskopem tak głęboko, jak jest w stanie przeniknąć, podczas gdy mikroskop konfokalny skupia tylko mniejszą wiązkę światła na jednym, wąskim poziomie głębokości. CLSM osiąga kontrolowaną i bardzo ograniczoną głębię ostrości.
Podstawowy pomysł
Zasada obrazowania konfokalnego została opatentowana w 1957 roku przez Marvina Minsky'ego i ma na celu przezwyciężenie pewnych ograniczeń tradycyjnych szerokokątnych mikroskopów fluorescencyjnych . W konwencjonalnym (tj. szerokokątnym) mikroskopie fluorescencyjnym cała próbka jest równomiernie zalana światłem ze źródła światła. Wszystkie części próbki mogą być wzbudzane w tym samym czasie, a uzyskana fluorescencja jest wykrywana przez fotodetektor mikroskopu lub kamerę zawierającą dużą nieostrą część tła. W przeciwieństwie do tego, mikroskop konfokalny wykorzystuje oświetlenie punktowe (patrz funkcja rozproszenia punktu ) i otworek w płaszczyźnie sprzężonej optycznie przed detektorem, aby wyeliminować nieostry sygnał – nazwa „konfokalny” pochodzi od tej konfiguracji. Ponieważ wykrywane jest tylko światło wytwarzane przez fluorescencję bardzo blisko płaszczyzny ogniskowej , rozdzielczość optyczna obrazu , szczególnie w kierunku głębokości próbki, jest znacznie lepsza niż w przypadku mikroskopów szerokokątnych. Ponieważ jednak duża część światła z fluorescencji próbki jest blokowana w otworku, ta zwiększona rozdzielczość odbywa się kosztem zmniejszonej intensywności sygnału – dlatego często wymagane są długie ekspozycje . Aby zrównoważyć ten spadek sygnału po przekłuciu , intensywność światła jest wykrywana przez czuły detektor, zwykle fotopowielacz (PMT) lub fotodiodę lawinową , przekształcając sygnał świetlny w elektryczny.
Ponieważ tylko jeden punkt w próbce jest oświetlony na raz, obrazowanie 2D lub 3D wymaga skanowania w próbce na zwykłym rastrze (tj. prostokątnym wzorze równoległych linii skanowania). Wiązka jest skanowana w poprzek próbki w płaszczyźnie poziomej za pomocą jednego lub więcej ( sterowanych serwo ) luster oscylacyjnych. Ta metoda skanowania zwykle charakteryzuje się niskim opóźnieniem reakcji, a szybkość skanowania można zmieniać. Wolniejsze skanowanie zapewnia lepszy stosunek sygnału do szumu , co skutkuje lepszym kontrastem .
Grubość osiągana w płaszczyźnie ogniskowej jest określona przede wszystkim przez długość fali światła używane podzielonej przez aperturze numerycznej części obiektywu , a także od właściwości optycznych próbki. Możliwe cienkie przekroje optyczne sprawiają, że tego typu mikroskopy są szczególnie dobre w obrazowaniu 3D i profilowaniu powierzchni próbek.
Kolejne plasterki tworzą „stos Z”, który można albo przetworzyć w celu stworzenia obrazu 3D, albo połączyć w stos 2D (przeważnie pobierana jest maksymalna intensywność pikseli, inne popularne metody obejmują użycie odchylenia standardowego lub sumowanie pikseli).
Mikroskopia konfokalna zapewnia możliwość bezpośredniego, nieinwazyjnego, seryjnego cięcia optycznego nienaruszonych, grubych, żywych próbek przy minimalnym przygotowaniu próbki, jak również marginalną poprawę rozdzielczości bocznej w porównaniu z mikroskopią szerokokątną. Próbki biologiczne są często poddawane działaniu barwników fluorescencyjnych w celu uwidocznienia wybranych obiektów. Jednak rzeczywiste stężenie barwnika może być niskie, aby zminimalizować zakłócenia systemów biologicznych: niektóre instrumenty mogą śledzić pojedyncze cząsteczki fluorescencyjne. Ponadto techniki transgeniczne mogą tworzyć organizmy, które wytwarzają własne chimeryczne cząsteczki fluorescencyjne (takie jak fuzja GFP, zielonego białka fluorescencyjnego z białkiem będącym przedmiotem zainteresowania). Mikroskopy konfokalne działają na zasadzie wzbudzenia punktowego w próbce (punkt o ograniczonej dyfrakcji) i punktowej detekcji powstałego sygnału fluorescencyjnego. Otwór w detektorze stanowi fizyczną barierę, która blokuje nieostrą fluorescencję. Rejestrowane jest tylko ostre lub centralne miejsce dysku Airy'ego .
Techniki stosowane do skanowania poziomego
W handlu dostępne są cztery rodzaje mikroskopów konfokalnych:
Laserowe mikroskopy konfokalne wykorzystują wiele zwierciadeł (zwykle 2 lub 3 skanujące liniowo wzdłuż osi x i y) do skanowania lasera w poprzek próbki i „deskanowania” obrazu przez nieruchomy otworek i detektor. Ten proces jest zwykle powolny i nie działa w przypadku obrazowania na żywo, ale może być przydatny do tworzenia reprezentatywnych obrazów o wysokiej rozdzielczości stałych próbek.
Mikroskopy konfokalne z wirującym dyskiem ( dysk Nipkowa ) wykorzystują serię ruchomych otworków na dysku do skanowania plamek światła. Ponieważ seria otworków skanuje obszar równolegle, każdy otworek może unosić się nad określonym obszarem przez dłuższy czas, zmniejszając w ten sposób energię wzbudzenia potrzebną do oświetlenia próbki w porównaniu z laserowymi mikroskopami skaningowymi. Zmniejszona energia wzbudzenia zmniejsza fototoksyczność i fotowybielanie próbki, często czyniąc ją preferowanym systemem do obrazowania żywych komórek lub organizmów.
Mikroskopy konfokalne wzmocnione mikrosoczewkami lub podwójne wirujące krążki konfokalne działają na tych samych zasadach, co mikroskopy konfokalne z wirującą tarczą, z wyjątkiem tego, że druga wirująca tarcza zawierająca mikrosoczewki jest umieszczana przed wirującą tarczą zawierającą nakłucia. Każdy otworek ma przypisaną mikrosoczewkę. Mikrosoczewki wychwytują szerokie pasmo światła i skupiają je na każdym otworku, znacznie zwiększając ilość światła kierowanego do każdego otworka i zmniejszając ilość światła blokowanego przez wirującą tarczę. Mikroskopy konfokalne wzmocnione mikrosoczewkami są zatem znacznie bardziej czułe niż standardowe systemy z wirującym dyskiem. Yokogawa Electric wynalazł tę technologię w 1992 roku.
Mikroskopy z programowalną matrycą (PAM) wykorzystują elektronicznie sterowany przestrzenny modulator światła (SLM), który wytwarza zestaw ruchomych otworków. SLM to urządzenie zawierające tablicę pikseli z pewnymi właściwościami ( nieprzezroczystość , współczynnik odbicia lub skręcalność optyczną ) poszczególnych pikseli, które można regulować elektronicznie. SLM zawiera lustra mikroelektromechaniczne lub elementy ciekłokrystaliczne . Obraz jest zazwyczaj uzyskane przez urządzenie ze sprzężeniem ładunkowym (CCD) aparatu.
Każda z tych klas mikroskopów konfokalnych ma szczególne zalety i wady. Większość systemów jest zoptymalizowana pod kątem szybkości nagrywania (tj. przechwytywania wideo) lub wysokiej rozdzielczości przestrzennej. Laserowe mikroskopy konfokalne mogą mieć programowaną gęstość próbkowania i bardzo wysokie rozdzielczości, podczas gdy Nipkow i PAM używają stałej gęstości próbkowania określonej przez rozdzielczość kamery. Szybkość klatek obrazowania jest zwykle wolniejsza w przypadku systemów skanowania laserowego z jednym punktem niż w przypadku systemów z obrotowym dyskiem lub systemów PAM. Komercyjne mikroskopy konfokalne z obrotowym dyskiem osiągają częstotliwość odświeżania ponad 50 na sekundę – pożądaną cechę do dynamicznych obserwacji, takich jak obrazowanie żywych komórek.
W praktyce Nipkow i PAM pozwalają na równoległe skanowanie tego samego obszaru przez wiele otworków, o ile otworki są wystarczająco daleko od siebie.
Najnowocześniejszy rozwój konfokalnej laserowej mikroskopii skaningowej umożliwia teraz obrazowanie z lepszą niż standardowa szybkość wideo (60 klatek na sekundę) przy użyciu wielu mikroelektromechanicznych luster skanujących.
Konfokalne obrazowanie fluorescencji rentgenowskiej to nowsza technika, która umożliwia kontrolę nad głębokością, oprócz celowania w poziomie i pionie, na przykład podczas analizowania zakopanych warstw w obrazie.
Poprawa rozdzielczości
CLSM to technika obrazowania skaningowego, w której uzyskaną rozdzielczość można najlepiej wyjaśnić porównując ją z inną techniką skanowania, taką jak skaningowy mikroskop elektronowy (SEM). CLSM ma tę zaletę, że nie wymaga zawieszania sondy w nanometrach nad powierzchnią, jak na przykład w AFM lub STM , gdzie obraz uzyskuje się poprzez skanowanie cienką końcówką po powierzchni. Odległość od soczewki obiektywu do powierzchni (zwana odległością roboczą ) jest zwykle porównywalna z odległością konwencjonalnego mikroskopu optycznego. Różni się w zależności od konstrukcji optycznej systemu, ale typowe są odległości robocze od setek mikrometrów do kilku milimetrów.
W CLSM próbka jest oświetlana przez źródło lasera punktowego, a każdemu elementowi objętości towarzyszy dyskretne rozpraszanie lub intensywność fluorescencji. W tym przypadku wielkość skanowanego obszaru jest określona przez wielkość plamki (bliską granicy dyfrakcji ) układu optycznego, ponieważ obraz lasera skanującego nie jest nieskończenie małym punktem, ale trójwymiarowym wzorem dyfrakcyjnym. Wielkość tego wzoru dyfrakcyjnego i ogniskowa, którą definiuje, są kontrolowane przez aperturę numeryczną soczewki obiektywu systemu i długość fali użytego lasera. Można to uznać za klasyczną granicę rozdzielczości konwencjonalnych mikroskopów optycznych wykorzystujących oświetlenie o szerokim polu. Jednak dzięki mikroskopii konfokalnej możliwe jest nawet poprawienie granicy rozdzielczości technik oświetlenia szerokiego pola, ponieważ aperturę konfokalną można zamknąć w celu wyeliminowania wyższych rzędów wzoru dyfrakcyjnego. Na przykład, jeśli średnica otworka jest ustawiona na 1 jednostkę Airy'ego, wówczas tylko pierwszy rząd wzoru dyfrakcyjnego przechodzi przez aperturę do detektora, podczas gdy wyższe rzędy są blokowane, poprawiając w ten sposób rozdzielczość kosztem niewielkiego spadku jasności. W obserwacjach fluorescencyjnych granica rozdzielczości mikroskopii konfokalnej jest często ograniczona przez stosunek sygnału do szumu spowodowany małą liczbą fotonów zwykle dostępnych w mikroskopii fluorescencyjnej. Efekt ten można skompensować stosując bardziej czułe fotodetektory lub zwiększając intensywność oświetlającego źródła punktowego lasera. Zwiększenie intensywności oświetlenia laserem stwarza ryzyko nadmiernego wybielenia lub innego uszkodzenia badanej próbki, zwłaszcza w przypadku eksperymentów, w których wymagane jest porównanie jasności fluorescencji. Podczas obrazowania tkanek o zróżnicowanej refrakcji, takich jak gąbczasty mezofil liści roślin lub inne tkanki zawierające przestrzeń powietrzną, często widoczne są aberracje sferyczne, które pogarszają jakość obrazu konfokalnego. Takie aberracje można jednak znacznie zmniejszyć, umieszczając próbki w optycznie przezroczystych, nietoksycznych perfluorowęglowodorach, takich jak perfluorodekalina , która łatwo przenika do tkanek i ma współczynnik załamania światła prawie identyczny jak woda.
Zastosowania
CLSM jest szeroko stosowany w różnych dyscyplinach nauk biologicznych , od biologii komórki i genetyki po mikrobiologię i biologię rozwoju . Jest również stosowany w optyce kwantowej oraz obrazowaniu i spektroskopii nanokryształów.
Biologia i medycyna
Klinicznie CLSM jest stosowany w ocenie różnych chorób oczu i jest szczególnie przydatny do obrazowania, analizy jakościowej i ilościowej oceny komórek śródbłonka rogówki . Służy do lokalizacji i identyfikacji obecności elementów grzyba nitkowatego w zrębie rogówki w przypadkach keratomykozy , umożliwiając szybką diagnozę, a tym samym wczesne podjęcie ostatecznej terapii. Obiecujące są również badania nad technikami CLSM w procedurach endoskopowych ( endomikroskopia ). W przemyśle farmaceutycznym zalecono śledzenie procesu wytwarzania cienkowarstwowych postaci farmaceutycznych w celu kontroli jakości i jednorodności dystrybucji leków. Mikroskopia konfokalna jest również wykorzystywana do badania biofilmów — złożonych struktur porowatych, które są preferowanym siedliskiem mikroorganizmów. Niektóre z czasowych i przestrzennych funkcji biofilmów można zrozumieć jedynie poprzez badanie ich struktury w mikro- i mezoskali. Badanie mikroskali jest potrzebne do wykrycia aktywności i organizacji pojedynczych mikroorganizmów.
Optyka i krystalografia
CLSM jest używany jako mechanizm wyszukiwania danych w niektórych optycznych systemach przechowywania danych 3D i pomógł określić wiek papirusu Magdalena .
Zachowanie dźwięku
System IRENE wykorzystuje mikroskopię konfokalną do optycznego skanowania i odzyskiwania uszkodzonego historycznego dźwięku.
Warianty i ulepszenia
Poprawa rozdzielczości osiowej
Funkcja rozproszenia punktowego otworka jest elipsoidą, kilka razy dłuższą niż jest szeroka. Ogranicza to rozdzielczość osiową mikroskopu. Jedną z technik przezwyciężenia tego jest mikroskopia 4Pi, w której światło padające i lub emitowane może zakłócać zarówno nad, jak i pod próbką, aby zmniejszyć objętość elipsoidy. Alternatywną techniką jest mikroskopia konfokalna theta . W tej technice stożek oświetlającego światła i wykrywanego światła są względem siebie ustawione pod kątem (najlepsze wyniki, gdy są prostopadłe). Przecięcie dwóch funkcji rozproszenia punktów daje znacznie mniejszą efektywną objętość próbki. Z tego wyewoluował jednopłaszczyznowy mikroskop oświetleniowy . Dodatkowo można zastosować dekonwolucję przy użyciu eksperymentalnie wyprowadzonej funkcji rozproszenia punktu, aby usunąć nieostre światło, poprawiając kontrast zarówno w płaszczyźnie osiowej, jak i bocznej.
Super rozdzielczość
Istnieją warianty konfokalne, które osiągają rozdzielczość poniżej granicy dyfrakcji, takie jak mikroskopia zubożenia emisji stymulowanej (STED). Oprócz tej techniki dostępna jest szeroka gama innych (nie opartych na konfokalnych) technik super rozdzielczości, takich jak PALM, (d)STORM, SIM i tak dalej. Wszystkie mają swoje zalety, takie jak łatwość użycia, rozdzielczość i potrzeba specjalnego sprzętu, buforów lub fluoroforów.
Działanie w niskich temperaturach
Do obrazowania próbek w niskich temperaturach zastosowano dwa główne podejścia, oba oparte na architekturze współogniskowej mikroskopii skaningowej laserowej . Jednym z podejść jest zastosowanie kriostatu o przepływie ciągłym : tylko próbka ma niską temperaturę i jest kierowana optycznie przez przezroczyste okienko. Innym możliwym podejściem jest umieszczenie części optyki (zwłaszcza obiektywu mikroskopu) w kriogenicznym pojemniku Dewar . To drugie podejście, choć bardziej kłopotliwe, gwarantuje lepszą stabilność mechaniczną i pozwala uniknąć strat spowodowanych oknem.
Obrazy
β-tubulina w Tetrahymena ( pierwotniak rzęskowy ).
Zakodowany kolorem obraz filamentów aktynowych w komórce rakowej .
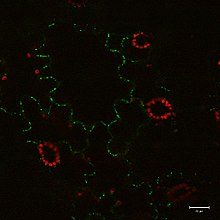
Zielony sygnał z przeciwciała przeciw tubulinie skoniugowanego z Alexa Fluor 488) i jądra (niebieski sygnał z DNA barwionego DAPI) w komórkach merystemu korzeniowego 4-dniowego Arabidopsis thaliana (Col-0). Skala: 5 um.
Historia
Początki: 1940-1957
W 1940 roku Hans Goldmann, okulista w Bernie w Szwajcarii, opracował system lamp szczelinowych do dokumentowania badań oczu. System ten jest uważany przez niektórych późniejszych autorów za pierwszy konfokalny system optyczny.
W 1943 Zyun Koana opublikował system konfokalny. Rysunek w tej publikacji przedstawia konfokalną ścieżkę wiązki transmisyjnej.
W 1951 Hiroto Naora, kolega Koany, opisał w czasopiśmie Science mikroskop konfokalny dla spektrofotometrii .
Pierwszy skaningowy mikroskop konfokalny został zbudowany przez Marvina Minsky'ego w 1955 roku, a patent został zgłoszony w 1957 roku. Skanowanie punktu oświetlenia w płaszczyźnie ogniskowej zostało osiągnięte poprzez przesunięcie stolika. Nie zgłoszono żadnej publikacji naukowej i nie zachowały się wykonane nią obrazy.
Tandemowy mikroskop skaningowy
W latach 60. czechosłowacki Mojmír Petráň z Wydziału Lekarskiego Uniwersytetu Karola w Pilźnie opracował Tandem-Scanning-Mikroscope, pierwszy komercyjny mikroskop konfokalny. Został sprzedany przez małą firmę w Czechosłowacji oraz w Stanach Zjednoczonych przez Tracor-Northern (później Noran) i wykorzystał obrotowy dysk Nipkowa do wygenerowania wielu otworów wzbudzających i emisyjnych.
Czechosłowacki patent został złożony w 1966 r. przez Petránia i Milana Hadravskich, czechosłowackiego współpracownika. Pierwsza publikacja naukowa z danymi i obrazami wygenerowanymi za pomocą tego mikroskopu została opublikowana w czasopiśmie Science w 1967, autorstwa M. Davida Eggera z Yale University i Petráň. W przypisie do tego artykułu wspomina się, że Petráň zaprojektował mikroskop i nadzorował jego budowę oraz że był po części „pracownikiem badawczym” w Yale. Druga publikacja z 1968 r. opisywała teorię i szczegóły techniczne instrumentu, a jako dodatkowych autorów miała Hadravský i Robert Galambos , szef grupy w Yale. W 1970 roku przyznano patent amerykański. Został złożony w 1967 roku.
1969: Pierwszy konfokalny laserowy mikroskop skaningowy
W 1969 i 1971 roku M. David Egger i Paul Davidovits z Yale University opublikowali dwa artykuły opisujące pierwszy konfokalny laserowy mikroskop skaningowy. Był to skaner punktowy, co oznacza, że wygenerowano tylko jeden punkt świetlny. Do obserwacji tkanki nerwowej wykorzystano mikroskopię epi-oświetleniowo-odbiciową. Laser helowo-neonowy o mocy 5 mW i świetle 633 nm został odbity przez półprzezroczyste zwierciadło w kierunku obiektywu. Obiektywem był prosty obiektyw o ogniskowej 8,5 mm. W przeciwieństwie do wszystkich wcześniejszych i większości późniejszych systemów, próbka była skanowana przez ruch tej soczewki (skanowanie obiektywne), co prowadziło do ruchu ogniska. Odbite światło wracało do półprzezroczystego zwierciadła, przepuszczana część była ogniskowana przez inną soczewkę na otworku detekcyjnym, za którym umieszczono tubę fotopowielacza. Sygnał był wizualizowany przez CRT oscyloskopu, promień katodowy poruszano jednocześnie z obiektywem. Specjalne urządzenie umożliwiło wykonanie zdjęć Polaroidem , z których trzy zostały pokazane w publikacji z 1971 roku.
Autorzy spekulują na temat barwników fluorescencyjnych do badań in vivo . Cytują patent Minsky'ego, dziękuję Steve'owi Baerowi, ówczesnemu doktorantowi w Albert Einstein School of Medicine w Nowym Jorku, gdzie opracował konfokalny mikroskop skaningowy, za sugerowanie użycia lasera z „mikroskopem Minsky'ego” i dziękuję Galambosowi: Hadravsky'emu i Petráňowi za dyskusje prowadzące do opracowania ich mikroskopu. Motywacją do ich opracowania było to, że w Tandemowym Mikroskopie Skaningowym tylko ułamek 10-7 światła oświetlającego uczestniczy w generowaniu obrazu w okularze. W związku z tym jakość obrazu nie była wystarczająca dla większości badań biologicznych.
1977–1985: Skanery punktowe z laserami i skanowaniem scenicznym
W 1977 roku Colin JR Sheppard i Amarjyoti Choudhury , Oxford , Wielka Brytania, opublikował analizę teoretyczną i konfokalnej laserowej skanujących mikroskopów. Jest to prawdopodobnie pierwsza publikacja używająca terminu „mikroskop konfokalny”.
W 1978 roku bracia Christoph Cremer i Thomas Cremer opublikowali projekt konfokalnego laserowego mikroskopu skanującego wykorzystującego wzbudzenie fluorescencyjne z elektronicznym autofokusem. Zaproponowali również oświetlenie punktowe laserem za pomocą „4π-punktowego hologramu ”. Ten projekt CLSM po raz pierwszy połączył metodę skanowania laserowego z trójwymiarową detekcją obiektów biologicznych oznaczonych markerami fluorescencyjnymi .
W 1978 i 1980 roku grupa z Oksfordu skupiona wokół Colina Shepparda i Tony'ego Wilsona opisała mikroskop konfokalny z oświetleniem epilaserowym, skaningiem scenicznym i fotopowielaczami jako detektorami. Stolik mógł poruszać się wzdłuż osi optycznej (oś z), umożliwiając szeregowe sekcje optyczne.
W 1979 roku Fred Brakenhoff i współpracownicy wykazali, że teoretyczne zalety przekrojów optycznych i poprawy rozdzielczości są rzeczywiście osiągalne w praktyce. W 1985 roku grupa ta jako pierwsza opublikowała przekonujące obrazy wykonane za pomocą mikroskopu konfokalnego, które były w stanie odpowiedzieć na pytania biologiczne. Wkrótce po tym, jak wiele innych grup zaczęło używać mikroskopii konfokalnej, aby odpowiadać na pytania naukowe, które do tej pory pozostawały tajemnicą ze względu na ograniczenia technologiczne.
W 1983 roku IJ Cox i C. Sheppard z Oksfordu opublikowali pierwszą pracę, w której mikroskop konfokalny był sterowany komputerowo. Pierwszy komercyjny laserowy mikroskop skaningowy, stage-scanner SOM-25, oferowany był przez Oxford Optoelectronics (po kilku przejęciach przejętych przez BioRad) od 1982 roku. Opierał się na projekcie grupy Oxford.
Od 1985 r.: Laserowe skanery punktowe ze skanowaniem wiązką
W połowie lat 80. William Bradshaw Amos i John Graham White wraz z kolegami pracującymi w Laboratorium Biologii Molekularnej w Cambridge zbudowali pierwszy skaningowy mikroskop konfokalny. Stolik z próbką nie poruszał się, zamiast tego poruszał się punkt oświetlenia, co pozwalało na szybszą akwizycję obrazu: cztery obrazy na sekundę po 512 linii każdy. Ogromnie powiększone obrazy pośrednie, dzięki drodze wiązki o długości 1-2 metrów, pozwoliły na zastosowanie konwencjonalnej przesłony irysowej jako „otworu otworkowego” o średnicy ~1 mm. Pierwsze mikrofotografie zostały wykonane z długotrwałą ekspozycją na kliszy przed dodaniem aparatu cyfrowego. Dalsza poprawa umożliwiła po raz pierwszy przybliżenie przygotowań. Zeiss , Leitz i Cambridge Instruments nie były zainteresowane produkcją komercyjną. Rada Badań Medycznych (MRC) w końcu zasponsorowała opracowanie prototypu. Projekt został przejęty przez Bio-Rad , poprawiony za pomocą sterowania komputerowego i skomercjalizowany jako „MRC 500”. Następca MRC 600 był później podstawą do opracowania pierwszego dwufotonowo-fluorescencyjnego mikroskopu opracowanego w 1990 roku na Uniwersytecie Cornell .
Rozwój w Królewskim Instytucie Technologicznym KTH w Sztokholmie mniej więcej w tym samym czasie doprowadził do komercyjnego CLSM dystrybuowanego przez szwedzką firmę Sarastro. Przedsięwzięcie zostało przejęte w 1990 roku przez Molecular Dynamics, ale CLSM zostało ostatecznie przerwane. W Niemczech firma Heidelberg Instruments , założona w 1984 r., opracowała CLSM, który początkowo był przeznaczony raczej do zastosowań przemysłowych niż do biologii. Instrument ten został przejęty w 1990 roku przez Leica Lasertechnik . Zeiss miał już na rynku niekonfokalny laserowy mikroskop skaningowy do latania, który został zmodernizowany do konfokalnego. W raporcie z 1990 roku wymieniono niektórych producentów konfokalnych: Sarastro, Technical Instrument, Meridian Instruments, Bio-Rad, Leica, Tracor-Northern i Zeiss.
W 1989 r. Fritz Karl Preikschat wraz z synem Ekhardem Preikschatem wynaleźli skaningowy mikroskop laserowy do analizy wielkości cząstek. Wraz z Ekhardem Preikschat założyli firmę Lasentec, aby ją skomercjalizować. W 2001 roku firma Lasentec została przejęta przez Mettler Toledo . Stosowane są głównie w przemyśle farmaceutycznym do zapewnienia kontroli in situ procesu krystalizacji w dużych systemach oczyszczania.
Zobacz też
- Spektroskopia modulacji ładunku
- Dekonwolucja
- Mikroskop fluorescencyjny
- Skupiona wiązka jonów
- Układanie ostrości
- Laserowa mikroskopia konfokalna skaningowa
- Obrazowanie żywych komórek
- Obiektyw mikroskopu
- Slajd mikroskopowy
- Mikroskop optyczny
- Skrawanie optyczne
- Fotodetektor
- Funkcja rozrzutu punktowego
- Mikroskop zubożony w emisje stymulacyjne
- Mikroskopia w super rozdzielczości
- Mikroskop fluorescencyjny z całkowitym wewnętrznym odbiciem (TIRF)
- Mikroskopia wzbudzenia dwufotonowego : Chociaż wykorzystują pokrewną technologię (oba są laserowymi mikroskopami skaningowymi), wielofotonowe mikroskopy fluorescencyjne nie są mikroskopami ściśle konfokalnymi. Termin konfokalny wynika z obecności przepony w sprzężonej płaszczyźnie ogniskowej (konfokalna). Ta diafragma jest zwykle nieobecna w mikroskopach wielofotonowych.
Bibliografia
- Hoffman, David P.; Sztengel, Gleb; Xu, C. Shan; Campbell, Kirby R.; Freeman, Melanie; Wang, Lei; Milkie, Daniel E.; Pasolli, H. Amalia; Iyer, Nirmala; Bogovic, John A.; Stabilny, Daniel R.; Shirinifard, Abbas; Pang, Pieśń; Peale, Dawidzie; Schäfer, Kathy; Pomp, Wim; Chang, Chi-Lun; Lippincott-Schwartz, Jennifer; Kirchhausena, Toma; Solecki, Dawid J.; Betzig, Eryk; Hess, Harald F. (2020). „Korelacyjna trójwymiarowa superrozdzielczość i mikroskopia elektronowa twarzy blokowej całych zamrożonych komórek szklistych” . Nauka . 367 (6475): eaaz5357. doi : 10.1126/science.aaz5357 . ISSN 0036-8075 . PMC 7339343 . PMID 31949053 .
Zewnętrzne linki
|
Zasoby biblioteczne dotyczące mikroskopii konfokalnej |
- Wirtualny CLSM (oparty na Javie)
- Animacje i objaśnienia dotyczące różnych typów mikroskopów, w tym mikroskopów fluorescencyjnych i konfokalnych (Université Paris Sud)