Wykrywanie koincydencji w neurobiologii - Coincidence detection in neurobiology
Wykrywanie koincydencji w kontekście neurobiologii to proces, w którym neuron lub obwód neuronowy może kodować informacje poprzez wykrywanie występowania czasowo bliskich, ale przestrzennie rozłożonych sygnałów wejściowych. Detektory koincydencji wpływają na przetwarzanie informacji przez neurony, zmniejszając drgania czasowe , zmniejszając spontaniczną aktywność i tworząc asocjacje między oddzielnymi zdarzeniami neuronalnymi. Koncepcja ta doprowadziła do lepszego zrozumienia procesów nerwowych i tworzenia map obliczeniowych w mózgu.
Zasady wykrywania koincydencji
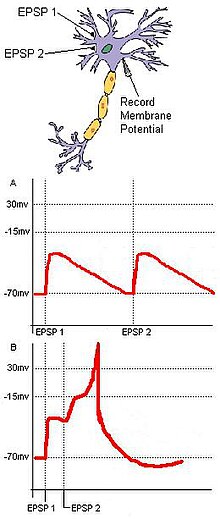
Wykrywanie koincydencji opiera się na oddzielnych wejściach zbieżnych we wspólnym celu. Rozważmy podstawowy obwód neuronowy z dwoma neuronami wejściowymi, A i B, które mają wzbudzające zaciski synaptyczne zbiegające się na jednym neuronie wyjściowym, C (ryc. 1). Jeśli EPSP każdego neuronu wejściowego jest podprogową dla potencjału czynnościowego w C, to C nie zostanie wystrzelone, chyba że dwa wejścia z A i B są czasowo blisko siebie. Synchroniczne nadejście tych dwóch sygnałów wejściowych może spowodować, że potencjał błonowy neuronu docelowego przekroczy próg wymagany do wytworzenia potencjału czynnościowego. Jeśli dwa wejścia oddalą się zbyt daleko, depolaryzacja pierwszego wejścia może mieć czas na znaczny spadek, uniemożliwiając potencjałowi błonowemu neuronu docelowego osiągnięcie progu potencjału czynnościowego. Ten przykład zawiera zasady sumowania przestrzennego i czasowego . Co więcej, wykrywanie koincydencji może zmniejszyć drgania powstałe w wyniku spontanicznej aktywności. Podczas gdy losowe stymulacje podprogowe przez komórki neuronowe często nie są uruchamiane przypadkowo, zbieżne sygnały synaptyczne pochodzące z jednolitego bodźca zewnętrznego zapewnią, że docelowy neuron zostanie aktywowany w wyniku bodźca.
Wykrywanie koincydencji dystalnej
Powyższy opis odnosi się dobrze do sygnałów wejściowych do neuronów, które dostarczają sygnały z nerwów czuciowych lub regionów niższego poziomu w mózgu. Około 90% połączeń międzyneuronowych nie ma jednak charakteru wyprzedzającego, ale predykcyjnego (lub modulacyjnego lub uwagi). Połączenia te otrzymują sygnały wejściowe głównie z pobliskich komórek w tej samej warstwie co komórka odbiorcza, a także z odległych połączeń, które są zasilane przez warstwę 1. Dendryty, które odbierają te sygnały, są dość odległe od ciała komórki, a zatem wykazują różne elektryczne i zachowanie przetwarzania sygnału w porównaniu z bliższymi (lub sprzężonymi) dendrytami opisanymi powyżej.
Na krótkim odcinku ( o długości około 40 µm ) dystalnego dendrytu reakcja na aktywacje zachodzące przez synapsy do kolców dendrytycznych działa w celu podniesienia ogólnego lokalnego potencjału z każdym przychodzącym sygnałem. Ten rosnący potencjał działa na tle zaniku potencjału z powrotem do poziomu spoczynkowego. Jeśli w krótkim czasie odebrane zostaną wystarczające sygnały (tj. zanim ogólne napięcie spadnie do poziomu tła), napięcie segmentu wzrośnie powyżej wartości progowej, powodując nieliniowy skok dendrytyczny, który przemieszcza się praktycznie bez zmniejszania wszystkich drogę do ciała komórki i co powoduje jego częściową depolaryzację.
Jest to prawdopodobnie najważniejsza forma wykrywania koincydencji dendrytycznych w mózgu. Łatwiejsza do zrozumienia aktywacja proksymalna działa przez znacznie dłuższe okresy czasu, a zatem jest znacznie mniej wrażliwa na czynnik czasu w wykrywaniu koincydencji.
Lokalizacja dźwięku
Wykazano, że wykrywanie koincydencji jest głównym czynnikiem w lokalizacji dźwięku wzdłuż płaszczyzny azymutu w kilku organizmach. W 1948 Lloyd A. Jeffress zaproponował, że niektóre organizmy mogą mieć zbiór neuronów, które odbierają sygnały słuchowe z każdego ucha. Ścieżki neuronowe prowadzące do tych neuronów nazywane są liniami opóźniającymi. Jeffress twierdził, że neurony, które łączą linie opóźniające, działają jak detektory koincydencji, aktywując maksymalnie podczas odbierania sygnałów jednocześnie z obu uszu. Kiedy słychać dźwięk, fale dźwiękowe mogą docierać do uszu w różnym czasie. Nazywa się to międzyuszną różnicą czasu (ITD). Ze względu na różne długości i skończoną prędkość przewodzenia w aksonach linii opóźniających, różne neurony wykrywające koincydencję będą aktywować, gdy dźwięk dobiegnie z różnych pozycji wzdłuż azymutu. Model Jeffress sugeruje, że dwa sygnały nawet z asynchronicznego nadejścia dźwięku do ślimaka każdego ucha będą zbiegać się synchronicznie w detektorze koincydencji w korze słuchowej opartym na wielkości ITD (ryc. 2). Dlatego ITD powinna odpowiadać mapie anatomicznej, którą można znaleźć w mózgu. Badania Masakazu Konishiego dotyczące płomykówek pokazują, że to prawda. Informacja czuciowa z komórek rzęsatych uszu wędruje do ipsilateralnego jądra magnocellularis. Stąd sygnały wychodzą ipsilateralne i kontralateralne do dwóch laminari jądra. Każde jądro laminaris zawiera detektory koincydencji, które odbierają sygnał dźwiękowy z lewego i prawego ucha. Ponieważ aksony ipsilateralne wchodzą do jądra laminaris grzbietowo, a aksony kontralateralne brzusznie, dźwięki z różnych pozycji wzdłuż azymutu odpowiadają bezpośrednio stymulacji różnych głębokości jądra laminaris. Na podstawie tych informacji powstała neuronowa mapa przestrzeni słuchowej. Funkcja jądra laminaris jest podobna do funkcji przyśrodkowej górnej oliwki u ssaków.
Plastyczność synaptyczna i asocjatywność
W 1949 Donald Hebb postulował, że wydajność synaptyczna wzrośnie poprzez powtarzaną i uporczywą stymulację komórki postsynaptycznej przez komórkę presynaptyczną. Jest to często nieformalnie podsumowane jako „ ogniwa, które razem, połączone ze sobą ”. Teoria została częściowo potwierdzona przez odkrycie długoterminowego wzmocnienia . Badania LTP na wielu komórkach presynaptycznych stymulujących komórkę postsynaptyczną ujawniły właściwość asocjatywności. Słaba stymulacja neuronalna neuronu piramidowego może nie wywoływać długotrwałego wzmocnienia. Jednak ta sama stymulacja w połączeniu z jednoczesną silną stymulacją z innego neuronu wzmocni obie synapsy . Proces ten sugeruje, że dwa szlaki neuronalne zbiegające się w tej samej komórce mogą wzmocnić się, jeśli zostaną przypadkowo stymulowane.
Molekularny mechanizm długotrwałego wzmocnienia
LTP w hipokampie wymaga przedłużonej depolaryzacji, która może usunąć blok Mg2 + postsynaptycznych receptorów NMDA . Usunięcie bloku Mg 2+ umożliwia przepływ Ca 2+ do komórki. Duży wzrost poziomu wapnia aktywuje kinazy białkowe, które ostatecznie zwiększają liczbę postsynaptycznych receptorów AMPA . Zwiększa to wrażliwość komórki postsynaptycznej na glutaminian . W rezultacie obie synapsy wzmacniają się. Przedłużona depolaryzacja potrzebna do wydalenia Mg 2+ z receptorów NMDA wymaga stymulacji o wysokiej częstotliwości. Asocjatywność staje się czynnikiem, ponieważ można to osiągnąć za pomocą dwóch równoczesnych danych wejściowych, które mogą nie być wystarczająco silne, aby same aktywować LTP.
Oprócz procesów opartych na receptorze NMDA, dalsze mechanizmy komórkowe pozwalają na powiązanie dwóch różnych sygnałów wejściowych zbiegających się na tym samym neuronie w określonym przedziale czasowym. Przy jednoczesnym wzroście wewnątrzkomórkowych stężeń cAMP i Ca2 + , aktywowany zostaje koaktywator transkrypcji zwany TORC1 ( CRTC1 ), który przekształca czasową koincydencję dwóch drugich przekaźników w długoterminowe zmiany, takie jak LTP. Ten mechanizm komórkowy, poprzez zależną od wapnia aktywację cyklazy adenylanowej , może również odpowiadać za wykrywanie powtarzalnej stymulacji danej synapsy .
Cyklaza adenylowa (znana również powszechnie jako cyklaza adenylowa i cyklaza adenylowa ) jest zaangażowana w tworzenie pamięci jako detektor koincydencji
Molekularny mechanizm długotrwałej depresji
Długotrwała depresja działa również poprzez właściwości asocjacyjne, chociaż nie zawsze jest to proces odwrotny do LTP. LTD w móżdżku wymaga jednoczesnej stymulacji włókien równoległych i pnących . Glutaminian uwalniany z włókien równoległych aktywuje receptory AMPA, które depolaryzują komórkę postsynaptyczną. Włókna równoległe aktywują również metabotropowe receptory glutaminianu, które uwalniają drugie przekaźniki IP 3 i DAG. Włókna pnące po aktywacji stymulują duży wzrost postsynaptycznego poziomu Ca 2+ . Ca 2+ , IP 3 i DAG współpracują w szlaku transdukcji sygnału internalizacji receptorów AMPA i zmniejsza czułość komórce postsynaptycznej glutaminianu.
Zobacz też
Bibliografia
Dalsza lektura
- Giętarka, VA; Bender, KJ; Brasier, DJ; Feldman, Niemcy (2006). „Dwa detektory koincydencji dla plastyczności zależnej od czasu impulsów w korze somatosensorycznej” . Dziennik Neuronauki . 26 (16): 4166–4177. doi : 10.1523/JNEUROSCI.0176-06.2006 . PMC 3071735 . PMID 16624937 .
- Caillard, O.; Ben-Ari, Y.; Gaiarsa, JL (1999). „Długotrwałe wzmocnienie transmisji synaptycznej GABAergicznej w hipokampie noworodków szczurów” . Czasopismo Fizjologii . 518 (Pt 1): 109-119. doi : 10.1111/j.1469-7793.1999.0109r.x . PMC 2269393 . PMID 10373693 .
- Joris, PX; Smith, PH; Yin, TC (1998). „Wykrywanie zbiegów okoliczności w układzie słuchowym: 50 lat po Jeffressie” . Neuron . 21 (6): 1235–1238. doi : 10.1016/S0896-6273(00)80643-1 . PMID 9883717 .
- https://web.archive.org/web/20040519194818/http://bbsonline.cup.cam.ac.uk/Preprints/OldArchive/bbs.neur4.crepel.html
Zewnętrzne linki
- Lokalizacja słuchowa przez analizę ITD: model Jeffress — interaktywny samouczek online (Flash)