Chlorambucyl - Chlorambucil
 | |
 | |
| Dane kliniczne | |
|---|---|
| Nazwy handlowe | Leukeran, inni |
| AHFS / Drugs.com | Monografia |
| MedlinePlus | a682899 |
| Drogi administracji |
Ustami |
| Kod ATC | |
| Status prawny | |
| Status prawny | |
| Dane farmakokinetyczne | |
| Biodostępność | ? |
| Metabolizm | Wątroba |
| Okres półtrwania eliminacji | 1,5 godziny |
| Wydalanie | Nie dotyczy |
| Identyfikatory | |
| |
| Numer CAS | |
| Identyfikator klienta PubChem | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| CZEBI | |
| CHEMBL | |
| Pulpit nawigacyjny CompTox ( EPA ) | |
| Karta informacyjna ECHA |
100.005.603 |
| Dane chemiczne i fizyczne | |
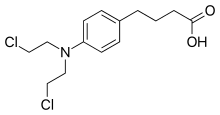
| Formuła | C 14 H 19 Cl 2 N O 2 |
| Masa cząsteczkowa | 304,21 g·mol -1 |
| Model 3D ( JSmol ) | |
| |
| |
| (zweryfikować) | |
Chlorambucil , sprzedawany między innymi pod marką Leukeran , jest lekiem chemioterapeutycznym stosowanym w leczeniu przewlekłej białaczki limfocytowej (CLL), chłoniaka Hodgkina i chłoniaka nieziarniczego . W przypadku CLL jest to preferowane leczenie. Podaje się go doustnie .
Częste działania niepożądane obejmują supresję szpiku kostnego . Inne poważne skutki uboczne obejmują zwiększone długoterminowe ryzyko dalszych nowotworów , bezpłodności i reakcji alergicznych . Stosowanie w czasie ciąży często szkodzi dziecku. Chlorambucyl należy do rodziny leków alkilujących . Działa poprzez blokowanie tworzenia DNA i RNA .
Chlorambucil został dopuszczony do użytku medycznego w Stanach Zjednoczonych w 1957 roku. Znajduje się na Liście Leków Podstawowych Światowej Organizacji Zdrowia , najbezpieczniejszych i najskuteczniejszych leków potrzebnych w systemie opieki zdrowotnej . Pierwotnie był zrobiony z musztardy azotowej .
Zastosowania medyczne
Obecnie chlorambucil stosuje się głównie w przewlekłej białaczce limfocytowej, ponieważ jest dobrze tolerowany przez większość pacjentów, chociaż chlorambucyl został w dużej mierze zastąpiony przez fludarabinę jako leczenie pierwszego rzutu u młodszych pacjentów. Może on być stosowany w leczeniu niektórych typów chłoniaków nieziarniczych , makroglobulinemia Waldenstróma , czerwienica prawdziwa , nowotwory trofoblastyczne , i raka jajników . Co więcej, był również stosowany jako lek immunosupresyjny w różnych stanach autoimmunologicznych i zapalnych, takich jak zespół nerczycowy .
Skutki uboczne
Supresja szpiku kostnego ( niedokrwistość , neutropenia , trombocytopenia ) jest najczęściej występującym działaniem niepożądanym chlorambucylu. Wycofany z leku ten efekt uboczny jest zwykle odwracalny. Podobnie jak wiele środków alkilujących , chlorambucyl jest powiązany z rozwojem innych form raka.
Rzadziej występujące skutki uboczne to:
- Zaburzenia żołądka i jelit ( nudności , wymioty , biegunka i owrzodzenia jamy ustnej ).
- Centralny układ nerwowy : napady padaczkowe, drżenie, drganie mięśni, splątanie, pobudzenie, ataksja i halucynacje.
- Reakcje skórne
- Hepatotoksyczność
- Bezpłodność
- Wypadanie włosów
Farmakologia
Mechanizm akcji
Chlorambucil wywołuje działanie przeciwnowotworowe, zakłócając replikację DNA i uszkadzając DNA w komórce. Uszkodzenie DNA indukuje zatrzymanie cyklu komórkowego i apoptozę komórek poprzez akumulację cytozolowego p53, a następnie aktywację białka X związanego z Bcl-2 , promotora apoptozy.
Alkilaty chlorambucylu i sieciują DNA we wszystkich fazach cyklu komórkowego, indukując uszkodzenie DNA za pomocą trzech różnych metod wytwarzania kowalencyjnych adduktów z DNA o podwójnej spirali:
- Przyłączenie grup alkilowych do zasad DNA, w wyniku czego DNA jest fragmentowany przez enzymy naprawcze w ich próbach zastąpienia alkilowanych zasad, zapobiegając syntezie DNA i transkrypcji RNA z zaatakowanego DNA.
- Uszkodzenie DNA poprzez tworzenie wiązań krzyżowych, które uniemożliwiają oddzielenie DNA do syntezy lub transkrypcji.
- Indukcja nieprawidłowego parowania nukleotydów prowadząca do mutacji.
Dokładne mechanizmy działania chlorambucylu w celu zabijania komórek nowotworowych nie są jeszcze w pełni poznane.
Ograniczenia biodostępności
Ostatnie badania wykazały, że chlorambucyl jest detoksykowany przez ludzką transferazę glutationową Pi (GST P1-1), enzym, który często występuje w nadekspresji w tkankach nowotworowych.
Jest to ważne, ponieważ chlorambucyl, jako elektrofil, jest mniej reaktywny przez sprzęganie z glutationem, przez co lek jest mniej toksyczny dla komórki.
Jak pokazano powyżej, chlorambucyl reaguje z glutationem katalizowanym przez hGSTA 1-1, prowadząc do powstania monoglutationylowej pochodnej chlorambucylu.
Chemia
Chlorambucil to krystaliczny lub ziarnisty proszek o barwie od białej do jasnobeżowej o lekkim zapachu. Po podgrzaniu do rozkładu wydziela bardzo toksyczne opary chlorowodoru i tlenków azotu.
Historia
Iperyty azotowe powstały w wyniku derywatyzacji iperytu siarkowego po tym, jak personel wojskowy narażony na jego działanie podczas I wojny światowej zaobserwowano spadek liczby białych krwinek. Ponieważ iperyt siarkowy był zbyt toksyczny, aby można go było stosować u ludzi, Gilman postawił hipotezę, że zmniejszając elektrofilowość środka, co czyni go wysoce reaktywnym chemicznie w stosunku do grup bogatych w elektrony, można uzyskać mniej toksyczne leki. W tym celu stworzył analogi, które były mniej elektrofilowe, zamieniając siarkę na azot, co prowadziło do iperytów azotowych.
Przy dopuszczalnym wskaźniku terapeutycznym u ludzi, iperyty azotowe zostały po raz pierwszy wprowadzone do kliniki w 1946 roku. Najpierw opracowano iperyty alifatyczne, takie jak chlorowodorek mechloretaminy (chlorowodorek musztardy), który jest nadal używany w klinice do dziś.
W latach pięćdziesiątych wprowadzono iperyty aromatyczne, takie jak chlorambucyl, jako mniej toksyczne środki alkilujące niż iperyty alifatycznego azotu, które okazały się mniej elektrofilowe i wolniej reagują z DNA. Dodatkowo środek ten można podawać doustnie, co jest istotną zaletą.
Chlorambucyl został po raz pierwszy zsyntetyzowany przez Everetta et al.
Bibliografia
Zewnętrzne linki
- Leukeran (strona producenta)
- „Chlorambucyl” . Portal informacyjny o narkotykach . Narodowa Biblioteka Medyczna Stanów Zjednoczonych.

