Adaptacyjny układ odpornościowy - Adaptive immune system
Adaptacyjnego systemu immunologicznego , określany również jako pozyskało system immunologiczny jest podsystem z systemem immunologicznym , który składa się z wyspecjalizowanych komórek, układowych i procesów, które eliminują patogeny lub zapobiegania ich wzrostowi. Nabyty układ odpornościowy jest jedną z dwóch głównych strategii odpornościowych występujących u kręgowców (drugą jest układ odporności wrodzonej ).
Podobnie jak układ wrodzony, adaptacyjny układ odpornościowy obejmuje zarówno składniki odporności humoralnej, jak i składniki odporności komórkowej i niszczy atakujące patogeny. W przeciwieństwie do wrodzonego układu odpornościowego , który jest zaprogramowany do reagowania na powszechne, szerokie kategorie patogenów, adaptacyjny układ odpornościowy jest wysoce specyficzny dla każdego konkretnego patogenu, z którym ma do czynienia organizm.
Odporność adaptacyjna tworzy pamięć immunologiczną po początkowej odpowiedzi na konkretny patogen i prowadzi do wzmocnionej odpowiedzi na przyszłe spotkania z tym patogenem. Przeciwciała są krytyczną częścią adaptacyjnego układu odpornościowego. Odporność adaptacyjna może zapewnić długotrwałą ochronę, czasami przez całe życie danej osoby. Na przykład ktoś, kto wyzdrowieje z odry, jest teraz chroniony przed odrą przez całe życie; w innych przypadkach nie zapewnia ochrony na całe życie, jak w przypadku ospy wietrznej . Ten proces odporności adaptacyjnej jest podstawą szczepienia .
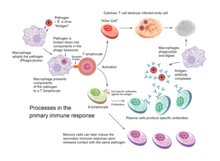
Komórki odpowiedzialne za adaptacyjną odpowiedź immunologiczną to białe krwinki znane jako limfocyty . Limfocyty B i limfocyty T , dwa różne typy limfocytów, wykonują główne czynności: odpowiedzi przeciwciał i odpowiedź immunologiczną pośredniczoną przez komórki. W odpowiedziach przeciwciał komórki B są aktywowane do wydzielania przeciwciał , które są białkami znanymi również jako immunoglobuliny. Przeciwciała przemieszczają się przez krwioobieg i wiążą się z obcym antygenem, powodując jego inaktywację, co nie pozwala antygenowi związać się z gospodarzem. Antygeny to wszelkie substancje, które wywołują adaptacyjną odpowiedź immunologiczną. Czasami system adaptacyjny nie jest w stanie odróżnić szkodliwych od nieszkodliwych obcych cząsteczek; skutkiem tego może być katar sienny , astma lub jakakolwiek inna alergia .
W odporności nabytej receptory specyficzne dla patogenu są „nabywane” w trakcie życia organizmu (podczas gdy w odporności wrodzonej receptory specyficzne dla patogenu są już zakodowane w genomie ). Ta nabyta odpowiedź nazywana jest „adaptacyjną”, ponieważ przygotowuje układ odpornościowy organizmu na przyszłe wyzwania (choć w rzeczywistości może być również nieprzystosowana, gdy powoduje alergie lub autoimmunizację ).
System jest bardzo elastyczny z dwóch powodów. Po pierwsze, hipermutacja somatyczna to proces przyspieszonych losowych mutacji genetycznych w genach kodujących przeciwciała, który umożliwia tworzenie przeciwciał o nowej specyficzności. Po drugie, rekombinacja V(D)J losowo wybiera jedną zmienną (V), jedną różnorodność (D) i jeden region łączący (J) do rekombinacji genetycznej i odrzuca resztę, co daje wysoce unikalną kombinację segmentów genów antygen-receptor w każdy limfocyt. Mechanizm ten umożliwia niewielkiej liczbie segmentów genetycznych generowanie ogromnej liczby różnych receptorów antygenowych, które są następnie w unikalny sposób wyrażane na każdym pojedynczym limfocytie . Ponieważ rearanżacja genów prowadzi do nieodwracalnej zmiany w DNA każdej komórki, całe potomstwo (potomstwo) tej komórki dziedziczy geny, które kodują tę samą specyficzność receptora, w tym komórki pamięci B i komórki T pamięci, które są kluczem do długowieczności specyficzna odporność.
Nazewnictwo
Termin „adaptacyjny” został po raz pierwszy użyty przez Roberta Gooda w odniesieniu do odpowiedzi przeciwciał u żab jako synonimu „nabytej odpowiedzi immunologicznej” w 1964 roku. Good przyznał, że używał tych terminów jako synonimów, ale wyjaśnił tylko, że wolał używać terminu „adaptacyjna”. ”. Mógł myśleć o niezbyt nieprawdopodobnej wówczas teorii tworzenia przeciwciał, w której przeciwciała były plastyczne i mogły dostosowywać się do molekularnego kształtu antygenów i/lub do koncepcji „enzymów adaptacyjnych” opisanych przez Monoda u bakterii, to znaczy , enzymy, których ekspresja może być indukowana przez ich substraty. Wyrażenie to było używane prawie wyłącznie przez Gooda i jego uczniów oraz kilku innych immunologów pracujących z organizmami marginalnymi aż do lat 90., kiedy stało się powszechnie używane w połączeniu z terminem „odporność wrodzona”, który stał się popularnym tematem po odkryciu układu receptora Tolla. w Drosophila , wcześniej marginalny organizm do badań immunologicznych. Termin „adaptacyjny” stosowany w immunologii jest problematyczny, ponieważ nabyte odpowiedzi odpornościowe mogą być zarówno adaptacyjne, jak i nieprzystosowane w sensie fizjologicznym. Rzeczywiście, zarówno nabyte, jak i wrodzone reakcje odpornościowe mogą być zarówno adaptacyjne, jak i nieprzystosowane w sensie ewolucyjnym. Większość dzisiejszych podręczników, po wczesnym użyciu przez Janeway , używa terminu „adaptacyjny” prawie wyłącznie i odnotowuje w słownikach, że termin ten jest synonimem „nabytego”.
Klasyczne znaczenie „odporności nabytej” zaczęło oznaczać, od czasu odkrycia Tonegawy , „odporność specyficzna dla antygenu, w której pośredniczą rearanżacje genów somatycznych, które tworzą receptory antygenowe definiujące klon”. W ostatniej dekadzie termin „adaptacyjny” był coraz częściej stosowany do innej klasy odpowiedzi immunologicznej, która nie była dotychczas związana z rearanżacjami genów somatycznych. Obejmują one ekspansję komórek naturalnych zabójców (NK) o dotychczas niewyjaśnionej specyficzności dla antygenów, ekspansję komórek NK eksprymujących receptory kodowane w linii zarodkowej oraz aktywację innych komórek odporności wrodzonej do stanu aktywacji, który nadaje krótkotrwałą „pamięć immunologiczną”. ”. W tym sensie „odporność adaptacyjna” bardziej przypomina pojęcie „stanu aktywowanego” lub „heterostazy”, powracając tym samym w sensie do fizjologicznego sensu „adaptacji” do zmian środowiskowych.
Funkcje
Odporność nabyta jest wyzwalana u kręgowców, gdy patogen unika wrodzonego układu odpornościowego i (1) generuje progowy poziom antygenu oraz (2) generuje sygnały „obce” lub „niebezpieczeństwo” aktywujące komórki dendrytyczne .
Główne funkcje nabytego układu odpornościowego obejmują:
- Rozpoznawanie specyficznych antygenów „nie-własnych” w obecności „własnego” podczas procesu prezentacji antygenu .
- Generowanie odpowiedzi dostosowanych do maksymalnego wyeliminowania określonych patogenów lub komórek zakażonych patogenami.
- Rozwój pamięci immunologicznej , w której patogeny są „zapamiętywane” poprzez komórki pamięci B i komórki T pamięci .
U ludzi adaptacyjny układ odpornościowy osiąga znaczącą odpowiedź w ciągu 4-7 dni.
Limfocyty
T i B limfocyty są komórki adaptacyjnego układu odpornościowego. Ciało ludzkie ma około 2 bilionów limfocytów, które stanowią 20-40% białych krwinek; ich całkowita masa jest mniej więcej taka sama jak w mózgu lub wątrobie . Krew obwodowa zawiera tylko 2% wszystkich krążących limfocytów; pozostałe 98% porusza się w obrębie tkanek i układu limfatycznego , który obejmuje węzły chłonne i śledzionę . U ludzi około 1-2% puli limfocytów krąży w obiegu co godzinę, aby zwiększyć możliwość kontaktu komórek z określonym patogenem i antygenem, na który reagują.
Limfocyty B i limfocyty T pochodzą z tych samych multipotencjalnych hematopoetycznych komórek macierzystych i wyglądają identycznie do czasu aktywacji. Limfocyty B odgrywają dużą rolę w humoralnej odpowiedzi immunologicznej , podczas gdy limfocyty T są ściśle związane z komórkową odpowiedzią immunologiczną . U wszystkich kręgowców z wyjątkiem Agnatha limfocyty B i T są wytwarzane przez komórki macierzyste w szpiku kostnym. Komórki progenitorowe T migrują następnie ze szpiku kostnego do grasicy , gdzie rozwijają się dalej.
U dorosłego zwierzęcia obwodowe narządy limfatyczne zawierają mieszaninę komórek B i T w co najmniej trzech etapach różnicowania:
- Naiwne limfocyty B i naiwne limfocyty T , które opuściły szpik kostny lub grasicę i weszły do układu limfatycznego, ale jeszcze nie napotkały odpowiadającego im antygenu
- Komórki efektorowe , które zostały aktywowane przez pasujący antygen i są aktywnie zaangażowane w eliminację patogenu
- Komórki pamięci, które przeżyły przeszłe infekcje
Prezentacja antygenu
Odporność nabyta polega na zdolności komórek odpornościowych do rozróżniania własnych komórek organizmu od niechcianych najeźdźców. Komórki gospodarza wyrażają „własne” antygeny . Te antygeny różnią się od tych na powierzchni bakterii lub na powierzchni komórek gospodarza zakażonych wirusem (antygeny „nie-własne” lub „obce”). Nabyta odpowiedź immunologiczna jest wyzwalana przez rozpoznanie obcego antygenu w kontekście komórkowym aktywowanej komórki dendrytycznej.
Z wyjątkiem komórek niejądrzastych (w tym erytrocytów ), wszystkie komórki są zdolne do prezentowania antygenu poprzez funkcję cząsteczek głównego układu zgodności tkankowej (MHC). Niektóre komórki są specjalnie przystosowane do prezentacji antygenu i do primingu naiwnych limfocytów T. Komórki dendrytyczne, komórki B i makrofagi są wyposażone w specjalne ligandy „kostymulujące” rozpoznawane przez receptory kostymulujące na komórkach T i są określane jako profesjonalne komórki prezentujące antygen (APC).
Kilka podgrup limfocytów T może być aktywowanych przez profesjonalne APC, a każdy typ limfocytów T jest specjalnie przystosowany do radzenia sobie z każdą unikalną toksyną lub patogenem drobnoustrojowym. Rodzaj aktywowanej komórki T i rodzaj wygenerowanej odpowiedzi zależy częściowo od kontekstu, w którym APC po raz pierwszy napotkało antygen.
Antygeny egzogenne
Komórki dendrytyczne pochłaniają w tkankach egzogenne patogeny, takie jak bakterie, pasożyty lub toksyny, a następnie migrują, poprzez sygnały chemotaktyczne , do węzłów chłonnych wzbogaconych w limfocyty T. Podczas migracji komórki dendrytyczne przechodzą proces dojrzewania, w którym tracą większość swojej zdolności do pochłaniania innych patogenów i rozwijają zdolność komunikowania się z komórkami T. Komórka dendrytyczna wykorzystuje enzymy do rozdrabniania patogenu na mniejsze kawałki, zwane antygenami . W węźle chłonnym komórka dendrytyczna wyświetla te obce antygeny na swojej powierzchni, łącząc je z receptorem zwanym głównym kompleksem zgodności tkankowej lub MHC (znanym również u ludzi jako ludzki antygen leukocytarny (HLA)). Ten kompleks MHC-antygen jest rozpoznawany przez komórki T przechodzące przez węzeł chłonny. Antygeny egzogenne są zwykle prezentowane na cząsteczkach MHC klasy II , które aktywują limfocyty T CD4 + .
Antygeny endogenne
Antygeny endogenne są wytwarzane przez bakterie wewnątrzkomórkowe i wirusy replikujące się w komórce gospodarza. Komórka gospodarza wykorzystuje enzymy do trawienia białek związanych z wirusem i wyświetla te fragmenty na swojej powierzchni komórkom T poprzez sprzęganie ich z MHC. Antygeny endogenne są zazwyczaj prezentowane na cząsteczkach MHC klasy I i aktywują cytotoksyczne komórki T CD8 +. Z wyjątkiem komórek niejądrzastych (w tym erytrocytów ), MHC klasy I ulegają ekspresji we wszystkich komórkach gospodarza.
Limfocyty T
Limfocyty T CD8+ i cytotoksyczność
Cytotoksyczne limfocyty T (znane również jako TC, zabójcze limfocyty T lub cytotoksyczne limfocyty T (CTL)) to podgrupa limfocytów T, które indukują śmierć komórek zakażonych wirusami (i innymi patogenami) lub w inny sposób uszkodzony lub dysfunkcyjny.
Naiwne cytotoksyczne komórki T są aktywowane, gdy ich receptor komórek T (TCR) silnie oddziałuje z cząsteczką MHC klasy I związaną z peptydem. To powinowactwo zależy od rodzaju i orientacji kompleksu antygen/MHC i jest tym, co utrzymuje wiązanie CTL i zainfekowanej komórki. Po aktywacji CTL przechodzi proces zwany selekcją klonalną , w którym zyskuje funkcje i szybko dzieli się, tworząc armię „uzbrojonych” komórek efektorowych. Aktywowany CTL wędruje następnie po całym ciele w poszukiwaniu komórek, które niosą ten unikalny peptyd MHC klasy I +.
Po wystawieniu na działanie tych zainfekowanych lub patologicznych komórek somatycznych efektorowych CTL uwalniania perforyny i granulysin : cytotoksyny, że postać porów w komórce docelowej błoną , dzięki czemu jony i przepływ wody do zakażonej komórki i powodując jej wybuch lub Łyse . CTL uwalnianie granzymu , A proteazy serynowej zawarta w granulce, która wnika do komórek poprzez pory do indukowania apoptozy (śmierć komórki). Aby ograniczyć rozległe uszkodzenia tkanek podczas infekcji, aktywacja CTL jest ściśle kontrolowana i ogólnie wymaga bardzo silnego sygnału aktywacji MHC/antygenu lub dodatkowych sygnałów aktywacji dostarczanych przez „pomocnicze” komórki T (patrz poniżej).
Po ustąpieniu infekcji większość komórek efektorowych umiera, a fagocyty je usuwają – ale kilka z tych komórek pozostaje jako komórki pamięci. Podczas późniejszego spotkania z tym samym antygenem te komórki pamięci szybko różnicują się w komórki efektorowe, radykalnie skracając czas wymagany do uzyskania skutecznej odpowiedzi.
Pomocnicze komórki T
Limfocyty CD4+, zwane także „pomocniczymi” komórkami T, są mediatorami odpowiedzi immunologicznej i odgrywają ważną rolę w ustalaniu i maksymalizacji zdolności nabytej odpowiedzi immunologicznej. Komórki te nie mają aktywności cytotoksycznej ani fagocytarnej; i nie może zabijać zainfekowanych komórek ani usuwać patogenów, ale w istocie "zarządzać" odpowiedzią immunologiczną, kierując inne komórki do wykonania tych zadań.
Komórki pomocnicze T wyrażają receptory komórek T (TCR), które rozpoznają antygen związany z cząsteczkami MHC klasy II. Aktywacja naiwnej pomocniczej komórki T powoduje, że uwalnia ona cytokiny, co wpływa na aktywność wielu typów komórek, w tym komórki APC (Antigen-Presenting Cell), która ją aktywowała. Komórki pomocnicze T wymagają znacznie łagodniejszego bodźca aktywacyjnego niż limfocyty T cytotoksyczne. Pomocnicze limfocyty T mogą dostarczać dodatkowe sygnały, które „pomagają” aktywować komórki cytotoksyczne.
Th1 i Th2: odpowiedzi limfocytów T pomocniczych
Klasycznie, dwa typy odpowiedzi efektorowych komórek pomocniczych T CD4 + mogą być indukowane przez profesjonalne APC, oznaczone Th1 i Th2, z których każdy ma na celu eliminację różnych typów patogenów. Czynniki decydujące o tym, czy infekcja wyzwala odpowiedź typu Th1 czy Th2, nie są w pełni zrozumiałe, ale wygenerowana odpowiedź odgrywa ważną rolę w usuwaniu różnych patogenów.
Odpowiedź Th1 charakteryzuje się wytwarzaniem interferonu-gamma , który aktywuje bakteriobójcze działanie makrofagów i pobudza komórki B do wytwarzania przeciwciał opsonizujących (oznaczających fagocytozę) i wiążących dopełniacz, co prowadzi do odporności komórkowej . Ogólnie odpowiedzi Th1 są bardziej skuteczne wobec patogenów wewnątrzkomórkowych (wirusów i bakterii znajdujących się w komórkach gospodarza).
Odpowiedź Th2 charakteryzuje się uwalnianiem interleukiny 5 , która indukuje usuwanie pasożytów przez eozynofile . Th2 wytwarzają również interleukinę 4 , która ułatwia przełączanie izotypów komórek B . Ogólnie, odpowiedzi Th2 są bardziej skuteczne przeciwko bakteriom zewnątrzkomórkowym , pasożytom, w tym robakom i toksynom . Podobnie jak cytotoksyczne limfocyty T, większość komórek pomocniczych CD4 + umiera po ustąpieniu infekcji, a kilka pozostaje jako komórki pamięci CD4 + .
Coraz częściej pojawiają się mocne dowody z badań naukowych prowadzonych na myszach i ludziach na większą różnorodność podzbiorów pomocniczych komórek T efektorowych CD4 + . Regulatorowe komórki T (Treg) zostały zidentyfikowane jako ważne negatywne regulatory odporności nabytej, ponieważ ograniczają i tłumią układ odpornościowy w celu kontrolowania nieprawidłowych odpowiedzi immunologicznych na własne antygeny; ważny mechanizm w kontrolowaniu rozwoju chorób autoimmunologicznych. Pęcherzykowe komórki pomocnicze T (Tfh) to kolejna odrębna populacja efektorowych komórek T CD4 + , które rozwijają się z naiwnych komórek T po aktywacji antygenu. Komórki Tfh specjalizują się we wspomaganiu odporności humoralnej komórek B, ponieważ mają wyjątkową zdolność do migracji do pęcherzykowych komórek B we wtórnych narządach limfatycznych i zapewniają im pozytywne sygnały parakrynne, aby umożliwić generowanie i przypominanie produkcji wysokiej jakości przeciwciał o dojrzałym powinowactwie . Podobnie jak Treg, komórki Tfh również odgrywają rolę w tolerancji immunologicznej, ponieważ nieprawidłowa ekspansja liczby komórek Tfh może prowadzić do nieograniczonego wytwarzania przeciwciał autoreaktywnych, powodując ciężkie ogólnoustrojowe zaburzenia autoimmunologiczne.
Znaczenie komórek pomocniczych CD4 + T jest podkreślane podczas infekcji HIV . HIV jest w stanie osłabić układ odpornościowy, atakując komórki CD4 + T, dokładnie komórki, które mogą prowadzić do usuwania wirusa, ale także komórki, które napędzają odporność na wszystkie inne patogeny napotkane w ciągu życia organizmu.
Komórki gamma delta T
Limfocyty T gamma delta (limfocyty T γδ) posiadają alternatywny receptor limfocytów T (TCR) w przeciwieństwie do limfocytów T CD4+ i CD8+ αβ i mają wspólne cechy limfocytów T pomocniczych, limfocytów T cytotoksycznych i limfocytów NK. Podobnie jak inne „niekonwencjonalne” podzbiory limfocytów T niosące niezmienne TCR, takie jak limfocyty T naturalni zabójcy z ograniczeniem CD1d , limfocyty T γδ wykazują cechy, które umieszczają je na granicy między odpornością wrodzoną a nabytą. Z jednej strony, limfocyty T γδ mogą być uważane za składnik odporności nabytej, ponieważ przestawiają geny TCR poprzez rekombinację V(D)J , która również wytwarza różnorodność połączeń i rozwijają fenotyp pamięci. Z drugiej jednak strony, różne podzbiory mogą być również uważane za część wrodzonego układu odpornościowego, gdzie ograniczone receptory TCR lub NK mogą być stosowane jako receptory rozpoznające wzorce . Na przykład, zgodnie z tym paradygmatem, duża liczba limfocytów T Vγ9/Vδ2 reaguje w ciągu godzin na zwykłe cząsteczki wytwarzane przez drobnoustroje, a wysoce ograniczone śródnabłonkowe limfocyty T Vδ1 odpowiadają na poddane stresowi komórki nabłonkowe.
Limfocyty B i produkcja przeciwciał
Komórki B są głównymi komórkami biorącymi udział w tworzeniu przeciwciał krążących w osoczu krwi i limfie, znanych jako odporność humoralna . Przeciwciała (znane również jako immunoglobuliny, Ig) to duże białka w kształcie litery Y używane przez układ odpornościowy do identyfikacji i neutralizacji ciał obcych. U ssaków występuje pięć typów przeciwciał: IgA , IgD , IgE , IgG i IgM , różniące się właściwościami biologicznymi; każdy ewoluował, aby radzić sobie z różnymi rodzajami antygenów. Po aktywacji komórki B wytwarzają przeciwciała, z których każde rozpoznaje unikalny antygen i neutralizuje określone patogeny.
Wiązanie antygenu i przeciwciała wywołałoby pięć różnych mechanizmów ochronnych:
- Aglutynacja: Zmniejsza liczbę jednostek zakaźnych, z którymi należy się uporać
- Aktywacja dopełniacza: powoduje stan zapalny i lizę komórek
- Opsonizacja: Powłoka antygenu przeciwciałem wzmaga fagocytozę
- Cytotoksyczność komórkowa zależna od przeciwciał: przeciwciała przyłączone do komórki docelowej powodują zniszczenie przez makrofagi, eozynofile i komórki NK
- Neutralizacja: Blokuje przyleganie bakterii i wirusów do błony śluzowej
Podobnie jak limfocyt T, limfocyty B wyrażają unikalny receptor limfocytów B (BCR), w tym przypadku związaną z błoną cząsteczkę przeciwciała. Cały BCR dowolnego klonu komórek B rozpoznaje i wiąże się tylko z jednym konkretnym antygenem. Krytyczna różnica między komórkami B i komórkami T polega na tym, jak każda komórka „widzi” antygen. Limfocyty T rozpoznają swój pokrewny antygen w postaci przetworzonej – jako peptyd w kontekście cząsteczki MHC, natomiast limfocyty B rozpoznają antygeny w postaci natywnej. Gdy komórka B napotka swój pokrewny (lub specyficzny) antygen (i otrzyma dodatkowe sygnały od pomocniczej komórki T (głównie typu Th2)), dalej różnicuje się w komórkę efektorową, znaną jako komórka plazmatyczna.
Komórki plazmatyczne to komórki krótko żyjące (2–3 dni), które wydzielają przeciwciała. Te przeciwciała wiążą się z antygenami, czyniąc je łatwiejszymi celami dla fagocytów i wyzwalają kaskadę dopełniacza . Około 10% komórek plazmatycznych przeżywa, aby stać się długo żyjącymi komórkami B pamięci swoistymi dla antygenu . Komórki te, już przygotowane do produkcji swoistych przeciwciał, mogą zostać wezwane do szybkiej odpowiedzi, jeśli ten sam patogen ponownie zakaże gospodarza, podczas gdy gospodarz doświadcza niewielu, jeśli w ogóle, objawów.
Systemy alternatywne
U bezszczękowych kręgowców
Prymitywne kręgowce bezszczękowe , takie jak minóg i śluzica , mają adaptacyjny układ odpornościowy, który wykazuje 3 różne linie komórkowe, z których każda ma wspólne pochodzenie z limfocytami B, limfocytami αβ T i wrodzonymi limfocytami T γΔ. Zamiast klasycznych przeciwciał i receptorów limfocytów T , zwierzęta te posiadają szeroką gamę cząsteczek zwanych zmiennymi receptorami limfocytów (w skrócie VLR), które, podobnie jak receptory antygenowe szczękowców kręgowców, są wytwarzane tylko z niewielkiej liczby (jednego lub dwóch) geny . Uważa się, że cząsteczki te wiążą patogenne antygeny w podobny sposób do przeciwciał i z takim samym stopniem swoistości.
U owadów
Przez długi czas uważano, że owady i inne bezkręgowce posiadają tylko wrodzony układ odpornościowy . Jednak w ostatnich latach u owadów odkryto niektóre z podstawowych cech odporności nabytej. Te cechy to pamięć immunologiczna i specyficzność. Chociaż znamiona są obecne , mechanizmy różnią się od tych u kręgowców .
Pamięć immunologiczna u owadów została odkryta dzięki zjawisku torowania. Kiedy owady są wystawione na nieśmiercionośną dawkę lub bakterie zabite ciepłem , są w stanie wytworzyć pamięć o tej infekcji, która pozwala im wytrzymać śmiertelną dawkę tych samych bakterii, na które były narażone wcześniej. W przeciwieństwie do kręgowców owady nie posiadają komórek specyficznych dla odporności adaptacyjnej. Zamiast tego w tych mechanizmach pośredniczą hemocyty . Hemocyty działają podobnie do fagocytów i po przygotowaniu są w stanie skuteczniej rozpoznawać i pochłaniać patogen. Wykazano również, że możliwe jest przekazanie pamięci potomstwu. Na przykład u pszczół miodnych, jeśli królowa jest zarażona bakteriami, nowo narodzone robotnice mają zwiększone zdolności w walce z tymi samymi bakteriami. Inny model eksperymentalny, oparty na chrząszczu mącznicy czerwonej, również wykazał specyficzny dla patogenu transfer pamięci do potomstwa zarówno od matek, jak i ojców.
Najczęściej akceptowana teoria specyficzności opiera się na genie Dscam . Gen Dscam, znany również jako cząsteczka adhezyjna komórki zespołu Downa, jest genem zawierającym 3 zmienne domeny Ig . Domeny te można alternatywnie łączyć, osiągając dużą liczbę odmian. Wykazano, że po ekspozycji na różne patogeny powstają różne formy splotów dscam. Po ekspozycji zwierząt o różnych formach splotu na ten sam patogen przeżywają tylko osobniki z formą splotu specyficzną dla tego patogenu.
Innym mechanizmem wspierającym specyfikę odporności owadów jest interferencja RNA (RNAi). RNAi to forma odporności przeciwwirusowej o wysokiej specyficzności. Ma kilka różnych ścieżek, z których wszystkie kończą się niezdolnością wirusa do replikacji. Jednym ze szlaków jest siRNA, w którym długi dwuniciowy RNA jest cięty na kawałki, które służą jako matryce dla kompleksu białkowego Ago2-RISC, który znajduje i degraduje komplementarny RNA wirusa. Szlak miRNA w cytoplazmie wiąże się z kompleksem Ago1-RISC i działa jako matryca do degradacji wirusowego RNA. Ostatnim z nich jest piRNA, w którym małe RNA wiąże się z rodziną białek Piwi i kontroluje transpozony i inne ruchome elementy. Pomimo badań dokładne mechanizmy odpowiedzialne za stymulację odpornościową i specyficzność u owadów nie są dobrze opisane.
Pamięć immunologiczna
Gdy komórki B i komórki T są aktywowane niektórzy zostają komórki B pamięci i niektórych komórek T pamięci . Przez całe życie zwierzęcia te komórki pamięci tworzą bazę danych skutecznych limfocytów B i T. Po interakcji z wcześniej napotkanym antygenem, odpowiednie komórki pamięci są wybierane i aktywowane. W ten sposób druga i kolejne ekspozycje na antygen wywołują silniejszą i szybszą odpowiedź immunologiczną. Jest to „adaptacyjne” w tym sensie, że układ odpornościowy organizmu przygotowuje się na przyszłe wyzwania, ale jest „nieprzystosowane” oczywiście, jeśli receptory są autoimmunologiczne. Pamięć immunologiczna może mieć postać albo pasywnej pamięci krótkotrwałej, albo aktywnej pamięci długotrwałej.
Pamięć pasywna
Pamięć bierna jest zwykle krótkotrwała, trwa od kilku dni do kilku miesięcy. Nowonarodzone niemowlęta nie miały wcześniejszego narażenia na drobnoustroje i są szczególnie narażone na zakażenia. Matka zapewnia kilka warstw ochrony biernej. W macicy , matki IgG transportowane bezpośrednio przez łożysko , dzięki czemu, po urodzeniu, ludzkie dzieci mają wysoki poziom przeciwciał, w tym samym zakresie swoistości względem antygenów jak matki. Mleko matki zawiera przeciwciała (głównie IgA), które są przenoszone do jelit niemowlęcia, chroniąc przed infekcjami bakteryjnymi, dopóki noworodek nie będzie w stanie zsyntetyzować własnych przeciwciał.
Jest to odporność bierna, ponieważ płód w rzeczywistości nie wytwarza żadnych komórek pamięci ani przeciwciał: tylko je pożycza. Krótkotrwałą odporność bierną można również przenosić sztucznie z jednej osoby na drugą za pomocą surowicy bogatej w przeciwciała .
Aktywna pamięć
Ogólnie rzecz biorąc, odporność czynna jest długotrwała i może być nabyta przez infekcję, po której następuje aktywacja komórek B i T, lub sztucznie nabyta przez szczepionki w procesie zwanym immunizacją.
Immunizacja
Historycznie, choroby zakaźne były główną przyczyną zgonów w populacji ludzkiej. W ciągu ostatniego stulecia opracowano dwa ważne czynniki w celu zwalczania ich rozprzestrzeniania się: warunki sanitarne i szczepienia . Immunizacja (powszechnie nazywana szczepieniem ) jest celową indukcją odpowiedzi immunologicznej i stanowi najskuteczniejszą manipulację układu odpornościowego, jaką opracowali naukowcy. Szczepienia są skuteczne, ponieważ wykorzystują naturalną specyfikę układu odpornościowego, a także jego indukowalność.
Zasadą immunizacji jest wprowadzenie antygenu pochodzącego z organizmu chorobotwórczego, który stymuluje układ odpornościowy do wytworzenia ochronnej odporności przeciwko temu organizmowi, ale który sam nie wywołuje patogennych skutków tego organizmu. Antygen (skrót anty ciała gen Erator) jest definiowany jako substancja, która wiąże się z przeciwciałem specyficznym i wywołuje adaptacyjnej odpowiedzi immunologicznej.
Większość szczepionek wirusowych opiera się na żywych, atenuowanych wirusach, podczas gdy wiele szczepionek bakteryjnych opiera się na bezkomórkowych składnikach mikroorganizmów, w tym nieszkodliwych składnikach toksyn . Wiele antygenów pochodzących ze szczepionek bezkomórkowych nie indukuje silnie odpowiedzi adaptacyjnej, a większość szczepionek bakteryjnych wymaga dodania adiuwantów, które aktywują komórki prezentujące antygen wrodzonego układu odpornościowego w celu zwiększenia immunogenności .
Różnorodność immunologiczna
Większość dużych cząsteczek, w tym praktycznie wszystkie białka i wiele polisacharydów , może służyć jako antygeny. Części antygenu, które oddziałują z cząsteczką przeciwciała lub receptorem limfocytów, nazywane są epitopami lub determinantami antygenowymi. Większość antygenów zawiera różne epitopy i może stymulować wytwarzanie przeciwciał, specyficzne odpowiedzi komórek T lub jedno i drugie. Bardzo mała część (mniej niż 0,01%) wszystkich limfocytów jest w stanie wiązać się z określonym antygenem, co sugeruje, że tylko kilka komórek reaguje na każdy antygen.
Aby nabyta odpowiedź na „zapamiętanie” i wyeliminowanie dużej liczby patogenów, układ odpornościowy musi być w stanie rozróżnić wiele różnych antygenów, a receptory rozpoznające antygeny muszą być produkowane w ogromnej różnorodności konfiguracji, w istocie jeden receptor (co przynajmniej) dla każdego innego patogenu, który może kiedykolwiek zostać napotkany. Nawet przy braku stymulacji antygenem człowiek może wytworzyć ponad 1 bilion różnych cząsteczek przeciwciał. Miliony genów byłyby wymagane do przechowywania informacji genetycznej, która wytwarza te receptory, ale cały ludzki genom zawiera mniej niż 25 000 genów .
Niezliczone receptory są wytwarzane w procesie znanym jako selekcja klonalna . Zgodnie z teorią selekcji klonalnej, po urodzeniu zwierzę losowo generuje ogromną różnorodność limfocytów (każdy z unikalnym receptorem antygenowym) na podstawie informacji zakodowanej w małej rodzinie genów. Aby wygenerować każdy unikalny receptor antygenu, geny te przeszły proces zwany rekombinacją V(D)J lub kombinatoryczną dywersyfikacją , w której jeden segment genu rekombinuje z innymi segmentami genu, tworząc pojedynczy unikalny gen. Ten proces składania generuje ogromną różnorodność receptorów i przeciwciał, zanim organizm kiedykolwiek napotka antygeny, i umożliwia układowi odpornościowemu odpowiedź na prawie nieograniczoną różnorodność antygenów. Przez całe życie zwierzęcia limfocyty, które mogą reagować na antygeny, z którymi faktycznie styka się zwierzę, są wybierane do działania – skierowanego przeciwko wszystkiemu, co wyraża ten antygen.
Zauważ, że wrodzone i nabyte części układu odpornościowego działają razem, a nie wbrew sobie. Nabyte ramię, limfocyty B i T nie mogłyby funkcjonować bez wrodzonego wkładu systemu. Komórki T są bezużyteczne bez komórek prezentujących antygen do ich aktywacji, a komórki B są okaleczone bez pomocy komórek T. Z drugiej strony, system wrodzony prawdopodobnie zostałby opanowany przez patogeny bez wyspecjalizowanego działania adaptacyjnej odpowiedzi immunologicznej.
Odporność nabyta podczas ciąży
Podstawą układu odpornościowego jest rozpoznanie „ja” kontra „nie-ja”. Dlatego szczególnie interesujące są mechanizmy chroniące płód ludzki (który jest uważany za „nie-ja”) przed atakiem układu odpornościowego. Chociaż nie pojawiło się żadne wyczerpujące wyjaśnienie tego tajemniczego i często powtarzanego braku odrzucenia, dwa klasyczne powody mogą wyjaśniać, w jaki sposób płód jest tolerowany. Po pierwsze, płód zajmuje część ciała chronioną przez nieimmunologiczną barierę, macicę , której układ odpornościowy nie patroluje rutynowo. Po drugie, sam płód może sprzyjać miejscowej immunosupresji u matki, być może poprzez proces wyczerpania aktywnych składników odżywczych. Bardziej nowoczesnym wyjaśnieniem tej indukcji tolerancji jest to, że specyficzne glikoproteiny ulegające ekspresji w macicy podczas ciąży tłumią odpowiedź immunologiczną macicy (patrz eu-FEDS ).
W czasie ciąży w żyworodnych ssaków (wszystkie ssaki wyjątkiem Stekowce ) endogenne retrowirusy (ERVs) są aktywowane i produkowane w dużych ilościach podczas wszczepiania zarodka. Obecnie wiadomo, że posiadają właściwości immunosupresyjne, co sugeruje ich rolę w ochronie zarodka przed układem odpornościowym matki. Ponadto wirusowe białka fuzyjne powodują powstawanie syncytium łożyskowego, aby ograniczyć wymianę komórek migrujących między rozwijającym się zarodkiem a ciałem matki (coś, czego nabłonek nie może zrobić wystarczająco, ponieważ niektóre komórki krwi specjalizują się w wstawianiu się między sąsiednie komórki nabłonkowe ). Działanie immunodepresyjne było początkowym normalnym zachowaniem wirusa, podobnym do HIV. Białka fuzyjne były sposobem na rozprzestrzenienie się infekcji na inne komórki, po prostu łącząc je z zakażoną (HIV również to robi). Uważa się, że przodkowie współczesnych ssaków żyworodnych wyewoluowali po zakażeniu tym wirusem, umożliwiając płodowi przetrwanie w układzie odpornościowym matki.
W ramach projektu genomu ludzkiego odkryto kilka tysięcy ERV zaklasyfikowanych do 24 rodzin.
Teoria sieci immunologicznych
Ramy teoretyczne wyjaśniające działanie nabytego układu odpornościowego zapewnia teoria sieci immunologicznej , oparta na interakcjach między idiotypami (unikalne cechy molekularne jednego klonotypu, tj. unikalny zestaw determinant antygenowych zmiennej części przeciwciała) i „anty- idiotypów (receptory antygenowe, które reagują z idiotypem tak, jakby był obcym antygenem). Ta teoria, która opiera się na istniejącej hipotezie selekcji klonalnej i jest rozwijana od 1974 roku głównie przez Nielsa Jerne'a i Geoffreya W. Hoffmanna , jest postrzegana jako istotna dla zrozumienia patogenezy HIV i poszukiwania szczepionki przeciwko HIV .
Stymulacja odporności adaptacyjnej
Jednym z najbardziej interesujących osiągnięć w naukach biomedycznych w ciągu ostatnich kilku dekad było wyjaśnienie mechanizmów pośredniczących w odporności wrodzonej. Jeden zestaw wrodzonych mechanizmów odpornościowych jest humoralny, taki jak aktywacja dopełniacza . Kolejny zestaw obejmuje receptory rozpoznające wzorce, takie jak receptory Toll-like , które indukują produkcję interferonów i innych cytokin zwiększających odporność komórek takich jak monocyty na infekcje. Cytokiny wytwarzane podczas wrodzonych odpowiedzi immunologicznych należą do aktywatorów adaptacyjnych odpowiedzi immunologicznych. Przeciwciała wywierają addytywne lub synergistyczne działanie z mechanizmami odporności wrodzonej. Niestabilne klastry HbS Band-3, główne integralne białko krwinek czerwonych; przeciwciała rozpoznają te klastry i przyspieszają ich usuwanie przez komórki fagocytarne. Zgrupowane białka pasma 3 z przyłączonymi przeciwciałami aktywują dopełniacz, a fragmenty dopełniacza C3 są opsoninami rozpoznawanymi przez receptor dopełniacza CR1 na komórkach fagocytujących.
Badanie populacyjne wykazało, że ochronne działanie anemii sierpowatej przeciwko malarii falciparum obejmuje nasilenie nabytej i wrodzonej odpowiedzi immunologicznej na pasożyta malarii, co ilustruje oczekiwane przejście od odporności wrodzonej do nabytej.
Powtarzające się infekcje malarią wzmacniają nabytą odporność i poszerzają jej działanie przeciwko pasożytom, które wykazują ekspresję różnych antygenów powierzchniowych . W wieku szkolnym większość dzieci wykształciła skuteczną odporność adaptacyjną przeciwko malarii. Obserwacje te rodzą pytania o mechanizmy, które sprzyjają przetrwaniu większości dzieci w Afryce, jednocześnie pozwalając niektórym na rozwój potencjalnie śmiertelnych infekcji.
W malarii, podobnie jak w innych infekcjach, wrodzona odpowiedź immunologiczna prowadzi do adaptacyjnej odpowiedzi immunologicznej i ją pobudza. Genetyczna kontrola odporności wrodzonej i nabytej jest obecnie dużą i kwitnącą dyscypliną.
Humoralne i komórkowe odpowiedzi immunologiczne ograniczają namnażanie pasożytów malarii, a wiele cytokin przyczynia się do patogenezy malarii, a także do rozwiązywania infekcji.
Ewolucja
Nabyty układ odpornościowy, który został najlepiej zbadany u ssaków, wywodzi się z żuchwowych ryb około 500 milionów lat temu. Większość cząsteczek, komórek, tkanek i związanych z nimi mechanizmów tego systemu obronnego znajduje się w rybach chrzęstnych . Receptory limfocytów , Ig i TCR, znajdują się u wszystkich kręgowców ze szczęką. Najstarsza klasa Ig, IgM, jest związana z błoną, a następnie wydzielana po stymulacji chrzęstnych rybich komórek B. Inny izotyp, IgW rekina, jest powiązany z IgD ssaków. TCR, zarówno α/β, jak i γ/δ, występują u wszystkich zwierząt, od gnatostomy po ssaki. Organizacja segmentów genów, które przechodzą rearanżację genów, różni się u ryb chrzęstnych, które mają formę skupień w porównaniu z formą translokonu u ryb kostnych lub ssaków. Podobnie jak TCR i Ig, MHC znajduje się tylko u kręgowców szczękowych. Geny zaangażowane w przetwarzanie i prezentację antygenu , a także geny klasy I i klasy II są ściśle powiązane w MHC prawie wszystkich badanych gatunków.
Komórki limfoidalne można zidentyfikować w niektórych deuterostomach przedkręgowych (np. jeżowce). Wiążą one antygen z receptorami rozpoznającymi wzorce (PRR) wrodzonego układu odpornościowego . U ryb bezszczękowych dwa podzbiory limfocytów wykorzystują zmienne receptory limfocytów (VLR) do wiązania antygenu. Różnorodność jest generowana przez rearanżację segmentów DNA opartych na LRR , w której pośredniczy deaminaza cytozynowa . Nie ma dowodów na istnienie genów aktywujących rekombinację (RAG), które przestawiają segmenty genów Ig i TCR u kręgowców ze szczęką.
Uważa się, że ewolucja AIS, opartego na cząsteczkach Ig, TCR i MHC, powstała w wyniku dwóch głównych zdarzeń ewolucyjnych: przeniesienia transpozonu RAG (prawdopodobnie pochodzenia wirusowego) i dwóch duplikacji całego genomu . Chociaż molekuły AIS są dobrze zakonserwowane, również szybko ewoluują. Jednak podejście porównawcze wskazuje, że wiele cech jest dość jednorodnych wśród taksonów. Wszystkie główne funkcje AIS pojawiły się wcześnie i szybko. Ryby bezszczękowe mają inny AIS, który opiera się na rearanżacji genów w celu wygenerowania różnych receptorów odpornościowych z funkcjonalną dychotomią, która jest równoległa do cząsteczek Ig i TCR. Wrodzony układ odpornościowy , który odgrywa ważną rolę w aktywacji AIS, jest najważniejszym systemem obronnym z bezkręgowców i roślin .
Rodzaje nabytej odporności
Odporność można nabyć aktywnie lub biernie. Odporność jest aktywnie nabywana, gdy dana osoba jest narażona na obce substancje, a układ odpornościowy reaguje. Bierna odporność występuje wtedy, gdy przeciwciała są przenoszone z jednego gospodarza na drugiego. Zarówno odporność nabytą aktywnie, jak i nabytą biernie można uzyskać w sposób naturalny lub sztuczny.
- Naturalnie nabyta odporność czynna – gdy osoba jest naturalnie narażona na działanie antygenów, zachoruje, a następnie wyzdrowieje.
- Naturalnie nabyta odporność bierna – polega na naturalnym transferze przeciwciał z matki na niemowlę. Przeciwciała przenikają przez łożysko kobiety do płodu. Przeciwciała mogą być również przenoszone przez mleko matki wraz z wydzielinami siary.
- Sztucznie nabyta odporność czynna – odbywa się poprzez szczepienie (wprowadzenie martwego lub osłabionego antygenu do komórki żywiciela).
- Sztucznie nabyta odporność bierna – polega na wprowadzeniu do organizmu ludzkiego przeciwciał, a nie antygenów. Te przeciwciała pochodzą od zwierzęcia lub osoby, która jest już odporna na tę chorobę.
| Naturalnie nabyte | Sztucznie nabyte |
|---|---|
| Aktywny – Antygen wnika do organizmu w sposób naturalny | Aktywny – Antygeny są wprowadzane do szczepionek. |
| Pasywny – przeciwciała przechodzą z matki na płód przez łożysko lub niemowlę z mlekiem matki. | Pasywny – wstępnie uformowane przeciwciała w surowicy odpornościowej są wprowadzane przez wstrzyknięcie. |
Zobacz też
Uwagi i referencje
- Uwagi
- Bibliografia